INTRODUCCIÓN
Las Angiospermas o plantas con
flores, son el componente principal de la mayoría de los ecosistemas
terrestres. Representan más del 95% de las plantas
vasculares que existen
hoy en día; su gran
diversidad morfológica, funcional y ecológica
han hecho de ellas el grupo dominante de plantas vivas, con más de
290.000 especies descritas (Ramírez-Barahona et al., 2020). Las plantas
con flores son componentes críticos de hábitats acuáticos y terrestres, y
esta dominancia como grupo fue establecida en el Cretácico temprano, en cuyos registros fósiles están claramente documentados su rápida
expansión y diversificación (Mandel, 2019). Darwin se ha referido al origen de
las angiospermas como un “abomina- ble misterio” en una carta enviada a J.D. Hooker (Darwin, Francis y Seward, 1903).
La extraordinaria diversidad de especies
de angiospermas es igualada por una excepcional variedad de estructuras. Las
flores muestran una enorme complejidad que van desde diminutas flores
masculinas hasta flores hermafroditas gi- gantes, lo que refleja una notable
plasticidad en su evolución y desarrollo (Friis, Pedersen y P.R. Crane, 2006).
La percepción sobre la evolución de las flores ha cambiado en los últimos años,
como resultado de los avances
en la comprensión sobre la filogenia de plantas y sobre todo, de los
trabajos con grandes bases de datos moleculares para la resolución de la
historia filogenética de los clados mayores de angiospermas. Así también, la visión de la flor primitiva ha cambiado en base
a estudios relacionados a grupos específicos de fósiles, a nuevos hallazgos paleobotánicos y a estudios basados
en técnicas de biología molecular (Endress, 2011; Sauquet
et al., 2017; De-Paula et al., 2018; Sokoloff et al., 2018;
Rümpler y Theißen, 2019).
Además, la información del registro
fósil de las angiospermas ha venido ampliándose en las últimas décadas, gracias
a que el descubrimiento de varios fósiles con flores ha añadido nuevos elementos al estudio de las
angiospermas (Friis, Pedersen y P.R. Crane, 2006). La gran diversificación de especies de las angiospermas fue datada en el periodo
del Cretácico temprano
y ha sido ligada, por mucho
tiempo, a la diversificación de insectos polinizadores. Sin embargo,
un estudio reciente ha demostrado que existe una brecha de al menos diez
millones de años entre el origen y diversificación inicial de las angiospermas, y el de los insectos polinizadores clave, cuyos principales
órdenes emergieron
en el Paleozoico o el Mesozoico
temprano (Asar, Ho y Sauquet, 2022).
Esta
revisión pretende brindar
un resumen de puntos resaltantes del estudio sobre el
origen de las angiospermas, a través de la síntesis
y análisis crítico de avances recientes
en el estudio del origen
y la evolución de las angiospermas, con énfasis en la relación
entre la evidencia
fósil y los estudios moleculares, así como en la reconstrucción de la flor ancestral y sus
tejidos reproductivos. Se busca responder a la interrogante del grado de contribución de los enfoques
filogenéticos, moleculares y paleobotánicos más recientes para la resolución del
“abominable misterio” del origen de las angiospermas. Se ofrece así, una
perspectiva integradora que combina hallazgos paleontológicos con desarrollos
recientes en genómica funcional y evo-devo,
destacando los desafíos
no resueltos y proponiendo nuevas líneas de investigación. Basado
en un contexto interdisciplinario,
este artículo busca contribuir a una comprensión más amplia y actualizada del
origen de las plan- tas con flores.
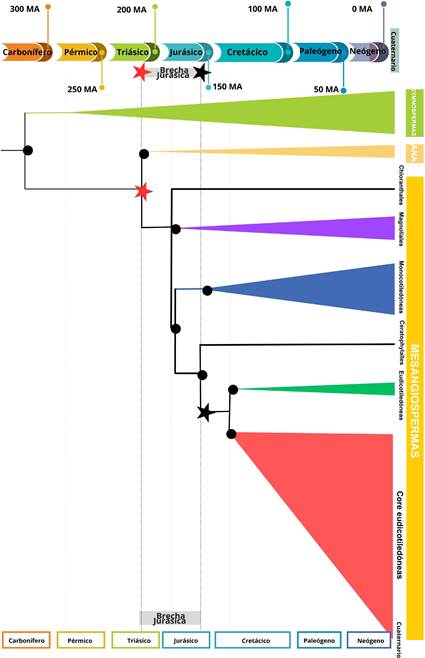
La brecha jurásica y el origen de las angiospermas
A la fecha aún existen controversias
con respecto a la datación del origen de las plantas con flores. Investigaciones basadas en análisis por relojes
moleculares ubican el origen de las angiospermas entre 256 y 139 millones de
años atrás (MDA) (Figura 1), ubicando
el espectro más temprano de datación en el Jurásico o incluso el Triásico (Li et al., 2019; Salomo et al.,
2017). Por el contrario, los fósiles más tempranos registrados, con
características afines a las angiospermas, datan del Cretácico temprano, entre
135 y 125 millones de años atrás. Se trata de granos de polen fosilizados que
han sido encontrados en regiones correspondientes al norte del antiguo
supercontinente Gondwana (Figura 2). Sin embargo, las dataciones de estos
fósiles no son muy consistentes con las de los fósiles
del Ancestro Común Más Reciente (ACMR) de las angiospermas vivientes,
pues estimaciones recientes realizadas vía
reloj molecular, ubican el origen de estas últimas 209 millones de
años atrás (Li et al., 2019). Existe entonces una brecha de al menos 70 millones
de años entre el fósil de angiosperma más antiguo conocido
y las dataciones obtenidas utilizando análisis moleculares, y a esta brecha
se la conoce como la “Brecha Jurásica” (Li et al., 2019;
Mandel, 2019). La edad del grupo de plantas con flores ha sido ampliamente
discutida a través de los años, desde estudios tempranos en la década
de 1960 hasta el presente, sin haberse llegado a un real
consenso (Herendeen et al.,
2017; Coiro et
al., 2019). Para algunos
autores la súbita y rápida diversificación de las angiospermas en el Cretácico
temprano (Figura 1) es una indicación de su origen y radiación en períodos aún más tempranos (Smith et al., 2010;
Herendeen et al., 2017; Ramírez-Barahona et al., 2020).
La morfología de las paredes
del polen es uno
de los caracteres más útiles para la reconstrucción de la evolución temprana de las plantas con flores. El registro fósil
de polen de angiospermas
proveniente del Cretácico es continuo, mientras que el reporte de polen precedente a este periodo es muy esporádico y altamente
contestado en su relación con las angiospermas (Herendeen et al., 2017).
Estudios recientes sostienen la hipótesis de un origen temprano de las plantas
con flores, seguido de un largo periodo de persistencia, an- tes de su rápida
diversificación (Li et al., 2019; Ramírez-Barahona et al., 2020).
La gran diversificación registrada entre el
Cretácico medio y superior, dio lugar a la mayoría de los linajes
hoy existentes (Vea y Grimaldi, 2016). La correspondencia entre
esta expansión mayor de las angiospermas y la diversificación de insectos y otros polinizadores ha sido largamente estudiada, pero en adición a
este factor pueden añadirse: por un lado, las condiciones ecológicas favorables, y por el otro, un
cambio morfológico sustancial en las primeras especies de plantas flores (de
Boer et al., 2012; Ramírez-Barahona et al., 2020)
Tres hipótesis han sido propuestas por Mandel (2019), para intentar explicar la
“Brecha Jurásica” en el registro fósil. La primera de el- las sugiere que las
angiospermas tempranas eran raras, y por lo tanto sus fósiles son difíciles de encontrar e identificar. La segunda postula
que el ambiente en el que se
desarrollaron las primeras angiospermas no era muy propicio
para la preservación de fósiles. Y la tercera hipótesis apunta a la anatomía
de las primeras angiospermas, que debieron tener flores y frutos muy pequeños,
complicando así la identificación de las mismas. El grupo más cercano
a las plantas con flores
son las demás plantas con semilla, o gimnospermas vivientes. La separación de los clados de gimno- spermas y angiospermas vivientes ha sido datada alrededor de 310 MDA (Figura 1),
lo que establece un límite de tiempo para datar al ACMR de las angiospermas vivientes. Zuniti y colaboradores (2024),
mencionan que la discordancia entre árboles genéticos sugiere una historia
evolutiva compleja, posiblemente atravesada por
eventos de varios hibridación y radiaciones rápidas. No obstante, los últimos
análisis realizados concluyen que, en realidad, la Brecha Jurásico sería tan
sólo un artefacto, producto de la mala interpretación de los registros fósiles
(Clark y Donoghue, 2025).
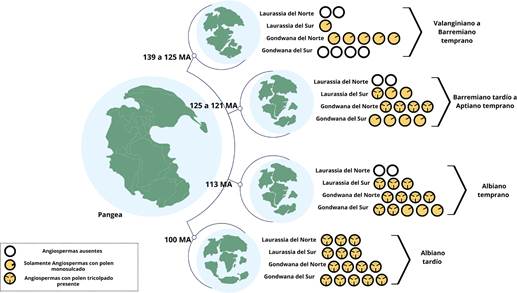
Otro punto de discusión concierne al origen geográfico
de las angiospermas. Los fósiles más tempranos conocidos son granos de polen
monoporado hallados en estratos que datan de hace 139 a 130 MDA, y han sido
localizados en re- giones que hoy corresponden al norte y centro de África, al Medio Oriente,
al oeste de Europa y al
sur de América (Coiro et al., 2019).
Los primeros fósiles de polen
conocidos pueden, por lo tanto, representar una expansión temprana de las angiospermas de su hábitat
original, en lugar de las primeras poblaciones de angiospermas que existieron. Estratos
más recientes en las mismas ubicaciones y estratos en muchas otras ubicaciones a lo largo de regiones
paleotrópicas y templadas,
contienen pólen tricolporados característicos
de las eudicotiledóneas, grupo más reciente
de angiospermas, las cuales han aparecido
probablemente 10-15 millones de años después de los primeros
tipos de polen de angiospermos conocidos (Coiro et al., 2019) (Figura 2).
El gineceo de la flor en el ACMR de las angiospermas vivas estaba
compuesto muy probablemente por carpelos separados, ascidiados
(en forma de botella). Probablemente, el ápice del carpelo no
estaba completamente fusionado por estructuras celulares, sino que tenía una
entrada restringida en forma de abertura o canal. Desde este canal se habrían
segregado sustancias para cerrar el ápice del carpelo y facilitar la entrada de los tubos polínicos (Endress y Doyle,
2015). Las superficies estigmáticas del carpelo ancestral estaban probablemente cubiertas por estrías multicelulares que pueden haber estado
físicamente en contacto entre carpelos adyacentes, formando un compitum intraginoecial para permitir el intercambio
de tubos polínicos (Endress y Doyle, 2015).
Posiblemente, el carpelo
ancestral contenía un único óvulo colgante, o un
pequeño número de ellos. Estos óvulos eran probablemente bitégmicos y
contenían, además del gametofito femenino, un gran nucelo, o tejido de
almacenamiento derivado de la estructura pistilada (Scutt, 2018).
Los frutos del ACMR de las angiospermas vivas eran probablemente indehiscentes (Endress y Doyle, 2015; Becker, 2020). El carpelo se considera como una hoja modificada que se
ha cerrado alrededor
de los óvulos, pero probablemente esta estructura guarda una
relación más directa con un esporófilo: una hoja especializada que porta uno o varios
esporangios. Si se considera que el carpelo está relacionado con el
megasporófilo (femenino) (aunque no es el caso al menos en una hipótesis de
Frohlich (2003), entonces las escamas del cono ovulado de las coníferas, por ejemplo, se considerarían homólogas al carpelo, más recientemente se ha plateado, que en las gimnospermas, las escamas que portan
los óvulos, no pueden plantearse como homólogas de hoja, puesto que
posiblemente provienen del funículo modificado del óvulo, con la hipótesis de que varios de ellos pudieron
haberse fusionado para formar una escama, lo que implica que si el carpelo es
un derivado de las escamas, cuenta con un origen funicular
igualmente (Herting y Stützel, 2022). No obstante, al comprar las angiospermas con el registro fósil existente, dependiendo
del candidato fósil que se tome como posible antepasado de las plantas con
flores, se pueden reconocer diferentes posibles precursores
anatómicos del carpelo.
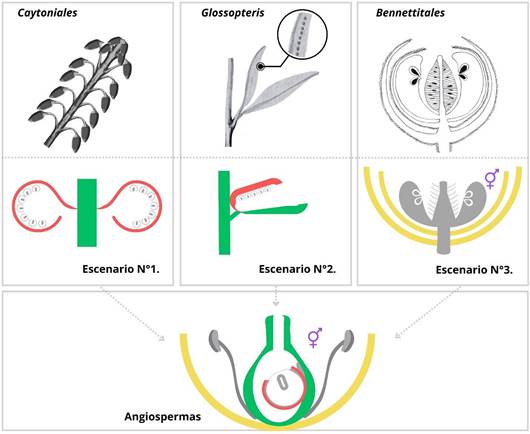
Doyle (2008) identificó tres grupos como posibles parientes cercanos del tronco
de las angiospermas, y éstos están relacionados con tres escenarios
evolutivos diferentes para el origen del carpelo y el tegumento externo del
óvulo de las angiospermas. En la primera de estas hipótesis, las gimnospermas similares a Caytonia se consideran
antepasados potenciales de las angiospermas, y en este caso el tegumento
externo habría evolucionado a partir de la cúpula mediante una reducción del número de óvulos a uno, dejando un único óvulo encerrado ahora en dos
capas de tejido, correspondientes a los dos tegumentos de las angiospermas. Si las gimnospermas similares a Caytonia fueron ancestrales de las angiosper-
mas, se ha planteado la hipótesis de que el raquis
femenino se expandió y se plegó alrededor
de los óvulos bitégmicos para
formar el carpelo.
En
un segundo escenario evolutivo, un eje re-
productor femenino de tipo Glossopteris se considera como posible
progenitor del tegumento externo y el carpelo de las angiospermas. En esta hipótesis, la
cúpula se convirtió en el tegumento externo, como en la primera hipótesis
anterior, relativa a Caytonia. Sin embargo, en el caso de Glossopteris, las cúpulas emergen
de una bráctea subtendida, y es esta bráctea la que se considera que posiblemente se cerró alrededor
de la cúpula/ óvulo bitégmico para formar el carpelo. Una dificultad
para esta hipótesis está relacionada con la fecha de extinción de las Glossopteris,
que podría haber precedido al origen de las plantas con flores (Doyle, 2008). De hecho, Glossopteris
también se ha sugerido como posible ancestro
de las Caytoniales (incluida Caytonia). Sin embargo, dado que
todavía hay muchas dudas sobre la fecha de origen de las angiospermas (como se ha comentado anteriormente), las Glossopteris
siguen siendo posibles candidatas como ancestros de las angiospermas.
El tercer escenario alternativo,
basado en los análisis de Doyle (2008), postula
que las Bennettitales fueron los ancestros de las angiospermas. Estas plantas tienen
megasporófilos unidos a un raquis central, que podría ser homólogo al carpelo, aunque no tienen órganos en forma de cúpula
de posible homología con el tegumento externo de las angiospermas (Figura 5).
Comentarios finales
Hasta hoy, el origen de las plantas
con flores sigue siendo un tema de debate, iniciando por la datación, que ha sido un tema de controversia debido a la discrepancia entre los registros fósiles y los análisis
moleculares, a la cual se conoce como la “Brecha Jurásica”. El
registro fósil más recientemente publicado (Han,
et al., 2023) sugiere que ya existían especies
de Angiospermas en el Jurásico medio,
sin embargo, aún es necesario llegar a un consenso
sobre los criterios prácticos, claramente declarados, para la identificación de
angiospermas fósiles.
Por
otro lado, la diversificación de las angiospermas, registrada principalmente en el Cretácico medio y superior, relacionada con la evolución
de estructuras florales
e históricamente vinculada a la diversificación de
insectos polinizadores se suma a los puntos de debate debido a estudios que
plantean una brecha temporal significativa entre ambos grupos. No obstante, un
trabajo reciente sugiere que el Ancestro
Común más Reciente de las angiospermas habría sido
polinizado por insectos (Stephens et al., 2023).
Se han propuesto tres hipótesis para
explicar la “Brecha Jurásica”, incluyendo: la rareza de fósiles, la falta de condiciones propicias para la
preservación de los mismos y la anatomía de las primeras plantas con flores.
Actualmente, el registro fósil sugiere un origen geográfico en regiones que hoy
corresponden a África, el Medio Oriente, Europa y América del Sur, y que habrían formado parte del norte
ecuatorial de Gondwana, con un clima húmedo, desde
donde se expand- ieron hacia áreas más secas y templadas durante un periodo de
10 a 15 millones de años.
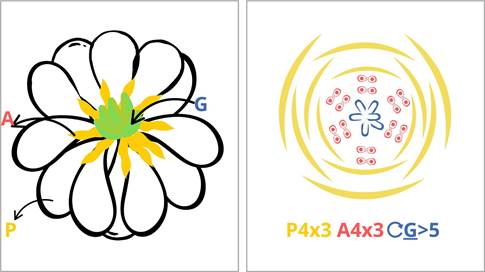
Las características evolutivas
distintivas de las plantas con flores son la presencia
del carpelo, los óvulos con
dos tegumentos, la bisexualidad, los estambres con cuatro lóculos
y la doble fertilización. Además,
presentan adaptaciones ecofisi- ológicas y vegetativas únicas.
Otro punto de gran
controversia en el estudio del origen de las angiospermas ha sido la reconstrucción
de la flor ancestral. Se han propuesto varias hipótesis sobre la apariencia de la primera
flor y sus posibles ancestros
utilizando datos fósiles y análisis filogenéticos, describiendo a la flor
ancestral como bisexual, actinomorfa, con un gineceo superior de cinco carpelos libres y estambres
en dos verticilos, rodeados
por un perianto trímero. No ob-
stante, la reconstrucción exacta de la flor ancestral sigue siendo un desafío
debido a la falta de registros fósiles claros y a la complejidad de la
evolución floral.
Las Angiospermas modernas se dividen
actualmente en dos grandes grupos:
grado-ANA y mesangiospermas. El grado-ANA incluye órdenes como
Amborellales, Nymphaeales y Austrobaileyales, mientras que las mesangiospermas
abarcan la mayoría de las especies de angiospermas. En cuanto a su relación con
las gimnospermas, se han sugerido candidatos como parientes más cercanos, entre ellos las Caytoniales y las
Bennettitales, cuestión que aún no se ha
resuelto por completo. Como se ha mencionado, una estructura clave en las
angiospermas es el carpelo, cuyos
precursores evolutivos han sido probablemente cúpulas de gimnospermas o
estructuras de Glossopteris. El carpelo ancestral contenía posiblemente
uno o más óvulos y desempeñó un papel crucial
en la protección de los
mismos y reproducción de las primeras plantas con flores. Trabajos recientes presentan posibles
escenarios evolutivos con estructuras de especies candidatas como precursoras
de los tejidos reproductivos femeninos, entre ellos el carpelo y el tegumento externo del óvulo de las
angiospermas.
El estudio del origen y la evolución
de las angiospermas es complejo y fascinante. En las últimas décadas,
gracias a estudios
que han combinado evidencia fósil, análisis moleculares y comparaciones
morfológicas, se han generado avances significativos hacia la comprensión de la historia evolutiva de las plantas con
flores las cuales se caracterizan por su notable diversidad morfológica y
ecológica que han propiciado su expansión y el dominio de la mayoría
de los eco- sistemas terrestres. A pesar de los avances en la
investigación, el “abominable misterio” de Darwin sobre el origen de las
angiospermas sigue siendo enigmático en ciertos aspectos.
AGRADECIMIENTOS
Especial agradecimiento los miembros del Equipo
de Evolución y Desarrollo de la Flor del Laboratorio de Reproducción y
Desarrollo de Plantas (RDP), Al comité de seguimiento de tesis
de la Escuela Doctoral 340 Biología Molecular Integrativa y Celular - BMIC de
la Universidad de Lyon – Francia y la Escuela
Normal Superior de Lyon -
Francia. A Cynthia Rivarola y Monserrat Pedrozo por sus aportes y comentarios. Al Programa de Becas Carlos Antonio López
(BE- CAL) de Paraguay que ha financiado el programa
de doctorado.
CONFLICTO DE
INTERÉS
El autor declara
que no existe conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
Amborella genome and the evolution of
flower- ing plants. Science 342(6165):1241089. DOI: 10.1126/science.1241089
Asar, Yasmin,
Simon Y.W. Ho, and Hervé Sau- quet.
“Early diversifications of angiosperms and their insect pollinators: were they
un- linked?” Trends in Plant Science, 2022: 858- 869.
Becker, A. (2020). A molecular update on the origin of the
carpel. Current Opinion in Plant Biology, 53, 15–22. https://doi.org/10.1016/j. pbi.2019.08.009
Bernhardt, P., Sage, T., Weston, P., Azuma, H., Lam, M.,
Thien, L. B., & Bruhl, J. (2003). The
pollination of Trimenia moorei (Trime- niaceae): Floral volatiles, insect/wind
pollen vectors and stigmatic
self-incompatibility in a
basal angiosperm. Annals of Botany, 92(3), 445–458. https://doi.org/10.1093/aob/mcg157
Carvalho, M. de A., Lana, C. C., Bengtson,
P., & Sa, N. de P. (2017).
Late Aptian (Cretaceous) climate changes
in northeastern Brazil:
A reconstruction based on indicator species anal- ysis (IndVal). Palaeogeography
Palaeoclima- tology Palaeoecology, 485, 543–560. https:// doi.org/10.1016/j.palaeo.2017.07.011
Clark James W. and Donoghue Philip C. J.
(2025).Uncertainty in the timing of diversifi- cation of flowering plants rests
with equivo- cal interpretation of their fossil recordR. Soc. Open
Sci.12242158. http://doi.org/10.1098/ rsos.242158
Coiro, M., Doyle, J. A., & Hilton, J. (2019). How deep is the conflict between molecular
and fossil evidence on the age of angiosperms? New Phytologist, 223(1),
83–99. https://doi. org/10.1111/nph.15708
de Boer, H. J., Eppinga, M. B.,
Wassen, M. J., & Dekker, S. C.
(2012). A critical transition in leaf
evolution facilitated the Cretaceous an- giosperm revolution. Nature Communications, 3(1), 1221. https://doi.org/10.1038/ncom-
ms2217
Darwin, Francis & Seward, A. C.
eds. 1903. More letters of Charles Darwin.
A record of his work in a
series of hitherto unpublished letters. London: John Murray. Volume 2.
https://darwin-online.org.uk/ content/frameset?itemID=F1548.2&view-
type=side&pageseq=98
De-Paula, O. C., Assis, L. C. S., & Craene, L. P. R. de. (2018).
Unbuttoning the Ancestral Flow- er of Angiosperms. Trends in Plant Science, 23(7),
551–554. https://doi.org/10.1016/j.
tplants.2018.05.006
Doyle, J. A. (1999). The rise of angiosperms as seen in the
African Cretaceous pollen record. In K. Heine, L. Scott, A. Cadman, & R.
Ver- hoeven (Eds.), Palaeoecology of Africa and the Surrounding Islands,
Vol. 26 (Vol. 26, pp. 3–29).
Doyle, James A. (2008). Integrating Molecular Phylogenetic
and Paleobotanical Evidence on Origin of the Flower. International Journal
of Plant Sciences, 169(7), 816–843. https://doi. org/10.1086/589887
Doyle, James A. (2012). Molecular and Fossil Evidence on
the Origin of Angiosperms. An- nual Review of Earth and Planetary Sciences,
40(1), 301–326. https://doi.org/10.1146/an- nurev-earth-042711-105313
Doyle, James A., Jardiné,
S., & Doerenkamp,
A. (n.d.). Afropollis, a new
genus of early an- giosperm pollen, with notes of the Cretaceous
palynostratigraphy and paleoenvironments of Northern Gondwana. Bulletin Des
Centres de Recherches Exploration-Production Elf-Aquit- aine, 6, 39–117.
Endress, P. K. (2011). Evolutionary diversifica- tion of
the flowers in angiosperms. American Journal of Botany, 98(3), 370–396. https://doi.
org/10.3732/ajb.1000299
Endress, P. K., & Doyle, J. A. (2007). Floral
phy- llotaxis in basal angiosperms: Development and evolution. Current
Opinion in Plant Bio- logy, 10(1), 52–57. https://doi.org/10.1016/j. pbi.2006.11.007
Endress, P. K., & Doyle, J. A. (2009). Recons-
tructing the ancestral angiosperm flower and its initial specializations. American
Journal of Botany, 96(1), 22–66. https://doi.org/10.3732/ ajb.0800047
Endress, P. K., & Doyle, J. A. (2015). Ances- tral traits and specializations in the flowers of the basal grade of living angiosper-
ms. TAXON, 64(6), 1093–1116. https://doi. org/10.12705/646.1
Friis, E.M., K.
Raunsgaard Pedersen, and P.R. Crane. “Cretaceous angiosperm flowers: In-
novation and evolution in plant
reproduction.” Palaeogeography, Palaeoclimatology, Pa- laeoecology. Volume
232, Issues 2–4.,
2006:
251-293.
Frohlich, M. W. (2003). An evolutionary scenario for the origin of flowers. Nature Reviews Ge- netics,
4(7), 559–566. https://doi.org/10.1038/ nrg1114
Frohlich, Michael W., & Chase, M. W. (2007). After a dozen years of progress
the origin of angiosperms is still a great mystery.
Nature, 450(7173),
1184–1189. https://doi. org/10.1038/nature06393
Group, T. A. P. (2009).
An update of the Angios- perm Phylogeny Group
classification for the orders and families
of flowering plants:
APG III. Botanical Journal
of the Linnean Socie- ty, 161(2),
105–121. https://doi.org/10.1111/ j.1095-8339.2009.00996.x
Group, T. A.
P., Chase, M. W., Christenhusz, M. J. M., Fay, M. F., Byng, J. W., Judd,
W. S., Soltis, D. E., Mabberley,
D. J., Sennikov, A. N., Soltis, P. S., & Stevens, P. F. (2016). An update
of the Angiosperm Phylogeny Group classification for the orders and families of
flowering plants: APG IV. Botanical Journal of the
Linnean Society, 181(1), 1–20. https://doi. org/10.1111/boj.12385
Han, Lei, Ya Zhao, Ming Zhao, Jie Sun, Bainian Sun, and Xin Wang. 2023. “New
Fossil Evi- dence Suggests That Angiosperms Flourished in the Middle Jurassic” Life 13, no. 3: 819. ht-
tps://doi.org/10.3390/life13030819
Herendeen, P. S., Friis, E. M., Pedersen, K. R., & Crane, P. R. (2017). Palaeobotanical
redux: Revisiting the age of the angiosperms. Na- ture Plants, 3(3), 1–8. https://doi.org/10.1038/ nplants.2017.15
Herting Julian, Thomas
Stützel, Evolution of the
coniferous seed scale, Annals of Botany, Vo- lume 129, Issue 7, 18 June 2022, Pages 753–760,
https://doi.org/10.1093/aob/mcab154 Jiao, Y., Wickett, N. J., Ayyampalayam, S.,
Chanderbali, A.
S., Landherr, L., Ralph, P. E., Tomsho, L. P.,
Hu, Y., Liang, H., Soltis, P. S., Soltis, D. E., Clifton, S. W., Schlarbaum, S. E., Schuster, S. C., Ma, H., Leebens-Mack,
J., & dePamphilis, C. W. (2011). Ancestral
poly- ploidy in seed plants and angiosperms. Nature, 473(7345), 97-U113.
https://doi.org/10.1038/ nature09916
Li, H.-T., Yi, T.-S., Gao, L.-M., Ma, P.-F., Zhang, T., Yang, J.-B., Gitzendanner, M. A., Fritsch,
P. W., Cai, J., Luo, Y., Wang, H., van der Bank, M., Zhang, S.-D.,
Wang, Q.-F., Wang, J.,
Zhang, Z.-R., Fu, C.-N., Yang, J., Holling- sworth, P. M., … Li, D.-Z. (2019).
Origin of angiosperms and the puzzle of the Jurassic gap. Nature Plants,
5(5), 461–470. https://doi. org/10.1038/s41477-019-0421-0
Mandel, J. R. (2019). A Jurassic leap for flow-
ering plants. Nature Plants, 5(5), 455–456. https://doi.org/10.1038/s41477-019-0423-y
Povilus, R. A., DaCosta, J. M.,
Grassa, C., Sa- tyaki, P. R. V.,
Moeglein, M., Jaenisch, J., Xi, Z., Mathews, S., Gehring, M., Davis, C. C.,
& Friedman, W. E. (2020). Water lily (Nym- phaea thermarum) genome reveals
variable ge- nomic signatures of ancient vascular
cambium losses. Proceedings of the National Academy of Sciences, 117(15),
8649–8656. https://doi. org/10.1073/pnas.1922873117
Ramírez-Barahona, S., Sauquet, H., & Magallón, S. (2020). The delayed and geographically het- erogeneous diversification of
flowering plant families. Nature Ecology & Evolution, 1–7. https://doi.org/10.1038/s41559-020-1241-3
Reyes, E., Nadot, S., von Balthazar, M., Schönen- berger, J., & Sauquet, H. (2018). Testing the impact of morphological rate heterogeneity on ancestral state reconstruction of five floral traits
in angiosperms. Scientific Reports, 8(1), 9473. https://doi.org/10.1038/s41598-018-27750-1
Reyes-Olalde, J. I., Zúñiga-Mayo, V.
M., Mar- sch-Martínez, N., & Folter, S. de. (2017).
Syn- ergistic relationship between auxin and cyto- kinin in the ovary
and the participation of the transcription factor SPATULA. Plant Signal- ing &
Behavior, 12(10), e1376158. https://doi. org/10.1080/15592324.2017.1376158
Reyes-Olalde, J. I., Zuñiga-Mayo, V.
M., Mon- tes, R. A. C., Marsch-Martínez, N., & Folter, S. de. (2013).
Inside the gynoecium: At the carpel margin. Trends in Plant Science, 18(11),
644–655. https://doi.org/10.1016/j.
tplants.2013.08.002
Rümpler, F., & Theißen,
G. (2019). Reconstruct- ing the ancestral flower
of extant angiosperms:
The ‘war of the whorls’ is
heating up. Journal of Experimental Botany, 70(10), 2615–2622. https://doi.org/10.1093/jxb/erz106
Salomo, K., Smith, J. F., Feild,
T. S., Samain, M.-S., Bond, L., Davidson, C., Zimmers, J., Neinhuis, C., & Wanke, S. (2017).
The Emergence of Earliest Angiosperms may be Earlier than Fossil Evidence
Indicates. Syste- matic Botany, 42(4), 607–619. https://doi.or- g/10.1600/036364417X696438
Sauquet, H., Balthazar, M. von,
Magallón, S., Doyle, J. A., Endress,
P. K., Bailes, E. J., Mo- rais, E. B. de, Bull-Hereñu, K., Carrive, L.,
Chartier, M., Chomicki, G., Coiro, M., Corne- tte, R., Ottra, J. H. L. E., Epicoco, C., Foster,
C. S. P., Jabbour, F., Haevermans, A., Haever-
mans, T., … Schönenberger, J. (2017). The ancestral flower of angiosperms and
its early diversification. Nature Communications, 8(1), 1–10. https://doi.org/10.1038/ncomms16047
Stephens, R.E., Gallagher, R.V., Dun,
L., Cor- nwell, W. and Sauquet, H. (2023), Insect po- llination for most of
angiosperm evolutionary history. New Phytol,
240: 880-891. https://doi. org/10.1111/nph.18993
Schonenberger, J. (2005). Rise from the ashes—
The reconstruction of charcoal fossil flowers. Trends in Plant Science, 10(9),
436–443. ht- tps://doi.org/10.1016/j.tplants.2005.07.006
Scutt, Charles P. (2018). The Origin of Angios- perms. In L.
Nuno de la Rosa & G. Müller (Eds.), Evolutionary
Developmental Biology: A Reference Guide (pp. 1–20). Springer
Interna- tional Publishing. https://doi.org/10.1007/978- 3-319-33038-9_60-1
Scutt, Charlie P., Vinauger-Douard,
M., Four- quin, C., Finet, C., & Dumas, C. (2006). An evolutionary
perspective on the regulation of carpel development. Journal of Experimen- tal Botany, 57(10), 2143–2152.
https://doi. org/10.1093/jxb/erj188
Smith, S. A., Beaulieu,
J. M., & Donoghue, M. J. (2010). An uncorrelated relaxed-clock analysis suggests an
earlier origin for flowering plants. Proceedings of the National Academy of
Sciences, 107(13), 5897–5902. https://doi. org/10.1073/pnas.1001225107
Sokoloff, D. D., Remizowa, M. V., Bateman, R. M., & Rudall, P. J. (2018). Was the
ancestral angiosperm flower whorled throughout? Ame- rican Journal of Botany,
105(1), 5–15. https:// doi.org/10.1002/ajb2.1003
Soltis, Douglas E., a Charles
D. Bell, Sangtae Kim, and and Pamela S. Soltis.
“Origin and Early Evolution
of Angiosperms.” Annals of the
New York Academy of Sciences, 2008: 25. Taylor, D. W., Li, H. Q., Dahl, J., Fago, F. J.,
Zinniker, D., & Moldowan, J. M. (2006). Bio- geochemical evidence for the
presence of the angiosperm molecular fossil oleanane in Pa-
leozoic and Mesozoic non-angiospermous fos- sils. Paleobiology, 32(2),
179–190. https://doi.
org/10.1666/0094-8373(2006)32[179:BEF- TPO]2.0.CO;2
Theissen, G., & Saedler, H. (2001). Plant biolo-
gy—Floral quartets. Nature, 409(6819), 469–471. https://doi.org/10.1038/35054172
Thien, L., White, D., & Yatsu, L. (1983). The
reproductive-biology of a relict illicium-Flori- danum ellis. American Journal of Botany, 70(5), 719–727.
https://doi.org/10.2307/2443126
Thomson, B., & Wellmer,
F. (2019). Chapter
Ei- ght—Molecular regulation of flower develop- ment. In U. Grossniklaus (Ed.), Current Topics in Developmental Biology (Vol.
131, pp. 185– 210). Academic Press. https://doi.org/10.1016/
bs.ctdb.2018.11.007
Vea, I. M., & Grimaldi, D. A.
(2016). Putting scales into evolutionary time: The divergen- ce of major scale insect lineages
(Hemiptera) predates the radiation of modern angiosperm hosts. Scientific
Reports, 6(1), 23487. https:// doi.org/10.1038/srep23487
Von Balthazar, M., Pedersen, K. R.,
Crane, P. R., Stampanoni, M., &
Friis, E. M. (2007). Potomacanthus lobatus gen. Et sp nov., a new flower of probable Lauraceae from the Early Cretaceous (Early to Middle
Albian) of eastern North America. American
Journal of Botany, 94(12), 2041–2053. https://doi.org/10.3732/ ajb.94.12.2041
Wang, Y.-Q., Melzer, R., & Theißen,
G. (2010). Molecular interactions of orthologues of floral
homeotic proteins from the gymnosperm Gne- tum gnemon provide
a clue to the evolutionary origin of ‘floral quartets.’ The
Plant Journal, 64(2), 177–190. https://doi.org/10.1111/j.1365313X.2010.04325.x
Zeng, L., Zhang, Q., Sun, R., Kong,
H., Zhang, N., & Ma, H. (2014). Resolution of deep an- giosperm phylogeny
using conserved nuclear genes and estimates of early divergence times. Nature Communications, 5(1), 4956.
https:// doi.org/10.1038/ncomms5956
![]() ; Scutt, C.2
; Scutt, C.2 ![]()