![]() 10.18004/rdgic.Investig.estud.UNA.2025.junio.2916015033
10.18004/rdgic.Investig.estud.UNA.2025.junio.2916015033
Ciencias Naturales ǀ ARTÍCULO ORIGINAL
*Autor correspondiente:
gustavo.villalba@cemit.una.py
Editora jefe:
Griselda
A. Meza Ocampos![]() , Universidad
Nacional de Asunción (UNA). Centro Multidisciplinario de Investigaciones
Tecnológicas (CEMIT). San Lorenzo, Paraguay.
, Universidad
Nacional de Asunción (UNA). Centro Multidisciplinario de Investigaciones
Tecnológicas (CEMIT). San Lorenzo, Paraguay.
Co-editora:
Juliana
Moura Mendes Arrúa![]() , Universidad
Nacional de Asunción (UNA). Centro Multidisciplinario de Investigaciones
Tecnológicas (CEMIT). San Lorenzo, Paraguay.
, Universidad
Nacional de Asunción (UNA). Centro Multidisciplinario de Investigaciones
Tecnológicas (CEMIT). San Lorenzo, Paraguay.
Recibido:
30 de diciembre de 2024
Revisado:
15 de enero de 2025
Aceptado:
04 de febrero de 2025
Recibido en versión modificada:
05 de marzo de 2025
Este
es un artículo publicado en acceso abierto bajo una Licencia Creative Commons “CC BY 4.0”. ![]()
Declaración de conflicto: Los autores declaran no tener conflicto de intereses.
e-ISSN 2709 -0817
Como citar: Villalba Duré, G., Segovia Corrales, E.A.L., Alvarenga, G., Valdez, M. E., Morínigo, M. y Da Costa, M. (2025). Resultados preliminares de los efectos genotóxicos de contaminantes domésticos e industriales del Arroyo Guazú, Departamento Central-Paraguay. Revista investigaciones y estudios – UNA, 16(1), pp. 15-25.
Resultados preliminares de los efectos genotóxicos de contaminantes domésticos e industriales del Arroyo Guazú, Departamento Central - Paraguay
Preliminary results of genotoxic effects of domestic and industrial pollutants from the Guazú Stream, Central Department-Paraguay
Gustavo Adolfo Villalba Duré1*![]() , Edith Alba Luz Segovia Corrales1
, Edith Alba Luz Segovia Corrales1![]() , Gerardo Alvarenga1
, Gerardo Alvarenga1![]() , Magalí Elizabeth Valdez1
, Magalí Elizabeth Valdez1![]() , Fernando Mathías Morínigo1
, Fernando Mathías Morínigo1![]() , Matías Da Costa1
, Matías Da Costa1![]()
1 Universidad Nacional de Asunción. Centro Multidisciplinario de Investigaciones Tecnológicas. San Lorenzo, Paraguay.
Resumen. Con el aumento de la urbanización, la gran mayoría de los ecosistemas acuáticos están sometidos a una intensa presión antrópica. Como consecuencia, la comunidad biológica está sujeta a un constante estrés, lo cual puede provocar daños a nivel celular. Por lo tanto, el objetivo del trabajo fue evaluar el efecto genotóxico de los contaminantes domésticos e industriales sobre el arroyo Guazú, localizado en la ciudad de San Antonio, Central- Paraguay que desemboca directamente en el Río Paraguay. Se realizó una campaña de muestreo en octubre de 2023 y se seleccionaron dos puntos: entrada y salida del arroyo. Se seleccionaron parámetros como pH, temperatura, oxígeno disuelto, turbidez, demanda bioquímica de oxígeno, nitrógeno total, fósforo total, coliformes totales, cromo total, cadmio y plomo. El efecto citotóxico y genotóxico se estimó a partir del cálculo del Índice Mitótico e Índice de Aberraciones cromosómicas en células meristemáticas de Allium cepa. Hubo una fuerte contaminación doméstica en el arroyo Guazú principalmente por una elevada carga de nutrientes y de coliformes totales. El índice Mitótico en ambos puntos fue inferior al 10%, lo cual se evidencia un leve efecto citotóxico, aunque no significativo. Sin embargo, se observó un efecto genotóxico significativo mediante el Índice de aberraciones cromosómicas observándose células binucleadas, en C- metafase, puentes cromosómicos, cromosomas pegajosos y cromosomas rezagados. Por tanto, debido a los efectos citotóxicos y genotóxicos leves observados, se recomienda realizar monitoreos periódicos para determinar si estas anomalías persisten y proponer estrategias de regulación del vertido de contaminantes domésticos e industriales.
Palabras clave: ambientes lóticos, Allium test, micronúcleo, nutrientes, metales pesados.
Abstract. With increasing urbanization, the vast majority of aquatic ecosystems are under intense anthropogenic pressure. As a consequence, the biological community is subjected to constant stress, which can cause damage at the cellular level. Therefore, the objective of the work was to evaluate the genotoxic effect of domestic and industrial pollutants on the Guazú stream, located in the city of San Antonio, Central-Paraguay, which flows directly into the Paraguay River. A sampling campaign was carried out in October 2023, and two points were selected: inlet and outlet of the stream. Parameters such as pH, temperature, dissolved oxygen, turbidity, biochemical oxygen demand, total nitrogen, total phosphorus, total coliforms, total chromium, cadmium and lead were selected. The cytotoxic and genotoxic effect was estimated from the calculation of the Mitotic Index and Chromosome Aberrations Index in meristematic cells of Allium cepa. There was a strong domestic pollution in the Guazú stream mainly due to a high load of nutrients and total coliforms. The mitotic index in both points was less than 10%, which shows a slight cytotoxic effect, although not significant. However, a significant genotoxic effect was observed by means of the index of chromosomal aberrations, observing binucleated cells, in C- metaphase, chromosomal bridges, sticky chromosomes and lagging chromosomes. Therefore, due to the mild cytotoxic and genotoxic effects observed, periodic monitoring is recommended to determine if these anomalies persist and to propose strategies to regulate the discharge of domestic and industrial pollutants.
Keywords: lotic environments, Allium test, micronucleus, nutrients, heavy metals.
Introducción
El aumento de la urbanización, impulsado por el crecimiento poblacional, ha generado modificaciones importantes en los ecosistemas acuáticos, fundamentalmente a consecuencia del uso inadecuado y la explotación intensiva de los recursos hídricos. Las actividades antropogénicas han deteriorado la calidad del agua mediante la introducción de contaminantes domésticos e industriales en los cursos hídricos, lo cual representa un riesgo tanto para la salud humana como para las comunidades bióticas que dependen de dichos recursos (Khatri y Tyagi, 2015; Londoño Franco et al., 2016).
En este contexto, la contaminación acuática surge como un agente estresor que altera las condiciones ambientales o propicia la bioacumulación de compuestos tóxicos, induciendo efectos agudos y/o crónicos en los organismos expuestos (Carolin et al., 2017). Este es el caso del arroyo Guazú, ubicado en el Departamento Central del Paraguay, el cual se encuentra sometido a una fuerte influencia antrópica. López Arias et al. (2021) han reportado la presencia de efluentes provenientes de actividades industriales (incluyendo talleres, petroleras, frigoríficos y fábricas), así como de vertidos domésticos, lo que compromete la calidad de sus aguas. Sin embargo, hasta la fecha no se han realizado estudios que evalúen la presencia de metales pesados ni el potencial genotóxico de los contaminantes que afectan este curso de agua.
Entre los diversos contaminantes, los metales pesados resultan especialmente preocupantes debido a su capacidad para inducir alteraciones en el ADN a nivel celular, generando efectos genotóxicos que pueden desencadenar fallos celulares y, en última instancia, la muerte del organismo (Blattner et al., 2020; Lionetto et al., 2021). En ese sentido, la literatura científica respalda la implementación de ensayos de evaluación genotóxica en el monitoreo ambiental (Kassa, 2021). En diversos estudios se ha evidenciado el potencial genotóxico en arroyos urbanos expuestos a contaminantes de origen doméstico e industrial (Carvalho Batista et al., 2016). A nivel nacional, investigaciones realizadas en el arroyo “Caañabé” han empleado ensayos de micronúcleo en alevines de Danio rerio, evidenciando una problemática similar a la del arroyo Guazú.
Por tanto, el objetivo del trabajo fue evaluar el efecto genotóxico de los contaminantes domésticos e industriales presentes en el arroyo “Guazú” mediante la aplicación del ensayo de Allium cepa. Este ensayo destaca por la accesibilidad del organismo, su facilidad en la manipulación, su sensibilidad a los contaminantes, su alta eficiencia, su corto tiempo de respuesta y su bajo costo, lo cual lo convierte en una herramienta idónea para monitoreo ambiental (Fiskesjö, 1985; Leme y Marín-Morales, 2009; Radić et al., 2009; Herrero et al., 2012). Ante la limitada cantidad de estudios previos en esta temática, el presente trabajo brinda otra perspectiva para evaluar los efectos genéticos inducidos por contaminantes, contribuyendo potencialmente a la mejora de la gestión y prestación de servicios ambientales.
Materiales y Métodos
Sitio de estudio y selección de los puntos de muestreo
El arroyo Guazú se encuentra localizado en la ciudad de San Antonio, Departamento Central y está formado por la unión de los arroyos Ñemby y Mbocayaty. El arroyo tiene una longitud aproximada de 1,25 Km y desemboca directamente en el Río Paraguay (Figuras 1 a-b).
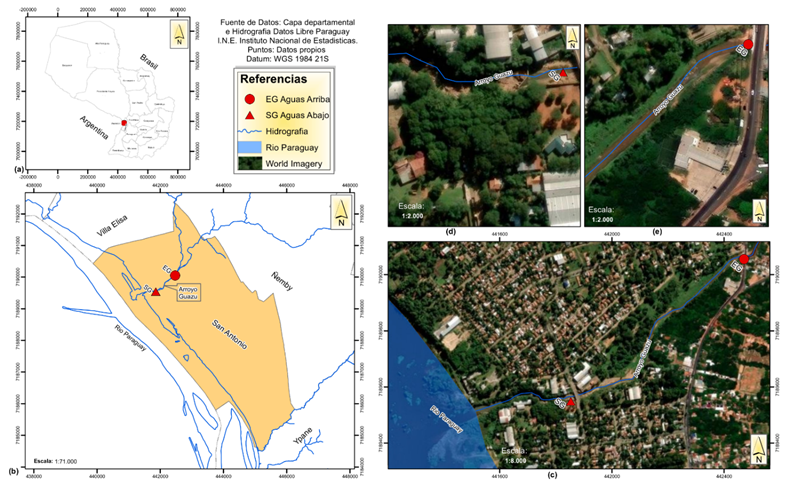
Figura 1. Mapa de localización geográfica del arroyo Guazú (a, b y c) imagen satelital con los puntos de muestreo. (d) SG-Salida del arroyo (aguas abajo) y (e) EG-Entrada del arroyo (aguas arriba).
Se realizó una campaña de muestreo en octubre del 2023, lo cual correspondió al periodo de primavera. Se seleccionaron dos puntos de muestreo que fueron escogidos mediante criterios basados principalmente en relación con la accesibilidad y a la localización del arroyo (Figura 1c). Así, los puntos de muestreo fueron denominados EG y SG respectivamente. El punto EG corresponde a la entrada del arroyo Guazú, producto de la intercepción entre los arroyos Ñemby y Mbocayaty (Figura 1e), mientras que el punto SG corresponde al tramo final del arroyo en la desembocadura con el Río Paraguay (Figura 1d).
Selección de variables fisicoquímicas y caracterización de los contaminantes domésticos e industriales
Para evaluar las condiciones fisicoquímicas del arroyo Guazú, se seleccionaron variables como el pH, temperatura, turbidez, oxígeno disuelto (OD), demanda bioquímica de oxígeno (DBO5), nitrógeno total (NT), fósforo total (FT) y coliformes totales. Para detectar la presencia de metales pesados, se seleccionaron las variables de Cromo total (Cr), cadmio (Cd) y plomo (Pb).
El pH permite detectar la contaminación química, mientras que la temperatura evalúa la contaminación térmica y la turbidez indica la presencia de sólidos en suspensión y materia orgánica, afectando la claridad y disponibilidad de luz en el ecosistema acuático (APHA/AWWA/WEF, 2023). El oxígeno disuelto (OD) y la demanda bioquímica de oxígeno (DBO₅) se cuantifican para analizar la presencia de materia orgánica biodegradable y su efecto en la disponibilidad de oxígeno (Raffo Lecca y Ruiz Lizama, 2014). Las variables de NT y FT indican contaminación por nutrientes, lo que puede provocar eutrofización y proliferación de algas, afectando negativamente los ecosistemas acuáticos (Khatri y Tyagi, 2015). La detección de coliformes totales se emplean para detectar contaminación de origen fecal o por descomposición orgánica y evaluar riesgos microbiológicos en el agua (APHA/AWWA/WEF, 2023).
En el sitio de muestreo, se midieron in situ las variables de pH, temperatura y oxígeno disuelto con un equipo multiparamétrico proporcionado por el laboratorio de calidad de agua del CEMIT-DGICT. Para las demás variables, se recolectaron muestras de agua en frascos de plástico, las cuales se mantuvieron refrigeradas hasta su análisis en el laboratorio de calidad de agua, siguiendo las indicaciones establecidas por APHA/AWWA/WEF (2023).
En el laboratorio, todas las determinaciones para las variables fisicoquímicas y metales pesados se realizaron siguiendo las metodologías establecidas en APHA/AWWA/WEF (2023) siendo estas los siguientes: el protocolo SM 5210 B para DBO5, SM 4500-NB para nitrógeno total, SM 4500 PE para fósforo total, SM 2130 B para turbidez, SM 9221 para los coliformes totales y SM 3111 para los metales pesados.
Determinación de los efectos genotóxicos en los puntos de muestreo
Se evaluaron los efectos genotóxicos de la muestra obtenida del arroyo mediante la técnica del Allium test (Leme y Marín-Morales, 2007). Para la obtención de células meristemáticas se sembraron semillas de Allium cepa (cebolla), adquiridas en el mercado local (Agritu Sementes®, Lote 81.3.15.13.01.3), a temperatura ambiente (20 ± 5 ◦C), en placas de Petri. Se realizaron 3 tratamientos (puntos EG, SG, control agua Ultrapura Millipore®), con 3 repeticiones cada una, utilizando 10 semillas por placa, totalizando 30 semillas por tratamiento. A los 5 días, cuando la radícula alcanzó 2 cm se procedió a realizar la fijación con etanol-ácido acético (3:1), por 24 horas, a 4° C.
Posteriormente las puntas de las raíces se depositaron en etanol 70% y almacenadas a 4°C antes del análisis. Las raíces fueron lavadas en agua destilada e hidrolizadas en ácido clorhídrico (HCl 1N), por 30 minutos. Luego se seleccionaron 9 raíces por tratamiento para la preparación de las láminas siguiendo los protocolos establecidos por Castillo Morales (2004). Las células se tiñeron con Giemsa al 4%. Para la evaluación, se prepararon 10 láminas portaobjetos y se contaron como mínimo 500 células en cada una totalizando 5.000 células meristemáticas por muestra/control. Para evaluar el efecto genotóxico, se han identificado aquellas células que han presentado aberraciones cromosómicas siguiendo la literatura disponible (López Arias et al., 2016; Rodríguez Soto, 2018; Sabeen et al., 2020).
Una vez identificado las aberraciones cromosómicas se calculó el Índice de Aberraciones Cromosómicas (IAC) a través de la siguiente ecuación (Sabeen et al., 2020):
IAC= [Número de aberraciones cromosómicas / Número Total de células] *100
Para evaluar el efecto citotóxico se estimó el porcentaje de las células en división celular por medio del cálculo del Índice Mitótico (IM) aplicando la siguiente ecuación (Fiskesjö, 1985):
IM= [Número de células en Mitosis / Número Total de células observadas] *100
Análisis de los datos
Una vez obtenido los datos se realizó un análisis descriptivo de la calidad del agua del arroyo Guazú. Para determinar el grado de contaminación doméstica e industriales se compararon los datos obtenidos tanto para los análisis fisicoquímicos y los metales pesados con los criterios establecidos por la Resolución N° 222/02 del MADES (2002) “Por La Cual Se Establece El Padrón de Calidad de Las Aguas En El Territorio Nacional” y la Resolución N° 255/06 del MADES (2006) “Por la cual se establece la clasificación de las aguas superficiales de la República del Paraguay”.
Para evaluar los efectos citotóxicos y genotóxicos (si hay diferencias significativas en el índice mitótico y el índice de aberraciones cromosómicas entre el control y los puntos de muestreo) se aplicó la prueba de Kruskal-Wallis que es un test no paramétrico que fue utilizado debido a que los datos no cumplieron con los supuestos de aleatoriedad, normalidad y homocedasticidad entre las varianzas (Kruskal y Wallis, 1952). En caso de que las diferencias entre los grupos fueran significativas, se realizó un análisis post hoc mediante la prueba de Dunn con corrección de Bonferroni para identificar específicamente en qué grupos se encontraron estas diferencias ajustando los valores de p para así controlar el error del tipo I (Dunn, 1961). Todos los análisis se realizaron con el software R utilizando el paquete “vegan” (Oksanen et al., 2019).
Resultados
Caracterización de las condiciones fisicoquímicas del arroyo Guazú
El análisis de las variables fisicoquímicas muestra que el arroyo Guazú presentó un nivel bajo de OD (< 5 mgO2.L-1 según la Resolución Nº 222), mientras que la DBO5 fue mayor en comparación con el OD en ambos sitios, siendo más elevada en la desembocadura (SG= 43,8 mgO2.L-1) (Tabla 1).
En cuanto a los valores de nutrientes, tanto FT como NT sobrepasaron los límites permitidos en la resolución N° 222 en ambos puntos (0,05 mgP.L-1 y 0,60 mgN.L-1). En el caso de los metales pesados, no se detectaron concentraciones superiores al límite de cuantificación, tanto para el Cr, Cd y Pb. Por lo tanto, dentro de los límites permitidos por la resolución N° 222. Los valores de pH en ambos se encontraron dentro del rango de pH entre 6 y 9, mientras que los coliformes totales estuvieron por encima de las 160.000 NMP.100 mL-1 lo cual corresponde a los límites superiores de cuantificación (Tabla 1).
Tabla 1. Caracterización física y química de los puntos del arroyo Guazú y los límites permitidos para aguas de Clase II de la Resolución N° 222 y Resolución N° 255/06.
|
Parámetros |
Unidad de medida |
EG (Entrada del arroyo) |
SG (Desembocadura al Río Paraguay) |
Límite Resol. N° 222-Clase II y Resol. N° 255/06 |
|
pH |
Unidad de pH |
7,5 |
7,6 |
6 - 9 |
|
Oxígeno disuelto |
mgO2.L-1 |
3,81 |
2,52 |
≥ 5,0 |
|
Temperatura del agua |
°C |
25,5 |
26,7 |
S/R |
|
Turbidez |
NTU |
15,15 |
19,65 |
≤100 |
|
Nitrógeno total |
mgN.L-1 |
5,06 |
4,70 |
0,60 |
|
Fósforo total |
mgP.L-1 |
0,64 |
0,80 |
0,05 |
|
Demanda bioquímica del oxígeno |
mgO2.L-1 |
8,07 |
43,8 |
S/R |
|
Cromo total |
mgCr.L-1 |
<0,05 |
<0,05 |
<0,5 |
|
Cadmio |
mgCd.L-1 |
<0,0001 |
<0,0001 |
<0,001 |
|
Plomo |
mgPb.L-1 |
<0,001 |
<0,001 |
<0,01 |
|
Coliformes totales |
NMP.100mL-1 |
>160.000 |
>160.000 |
S/R |
Nota: Sin Referencia (S/R).
Observación: Los valores en negrita corresponden a aquellos parámetros, cuyos valores se encuentran fuera del rango permitido por la Resolución N° 222.
Efecto citotóxico y genotóxico de las aguas del arroyo Guazú en semillas de Allium cepa
Para la evaluación del efecto citotóxico, el conteo de un mínimo de 5.000 células meristemáticas de las semillas de Allium cepa mostró que el número de células en mitosis en el grupo control fue mayor en comparación con los grupos de tratamiento. Esto se reflejó en una disminución del índice mitótico en los puntos EG (2,90 ± 3 %) y SG (4,42 ± 5 %) en comparación con el grupo control (10,6 ± 12 %) (Tabla 2). No obstante, la evidencia fue muy débil como para respaldar las diferencias entre los grupos (X2(2) = 5.06, P = 0,080).
Tabla 2. Número de células contadas en división celular, índice mitótico (IM) e porcentaje e Índice de aberraciones cromosómicas (ACs) en los puntos del arroyo Guazú.
|
Muestra |
N° células analizadas |
N° células en interfase |
N° células en mitosis |
IM (x̄ ± s) |
% IAC (x̄ ± s) |
N° células con ACs (%) |
|
CTL- |
5.024 |
4.490 |
534 |
10,6 ± 12 |
N/D |
0 (0) |
|
EG |
5.202 |
5.051 |
151 |
2,90 ± 3 |
0,21±0,19 |
11(0,21)* |
|
SG |
5.758 |
5.503 |
255 |
4,42 ± 5 |
0,44±0,29 |
29(0,44)* |
CTL-: Control negativo; N/D: No detectado; x̄: Media; s: Desviación estándar; *Estadísticamente significativo.
En cuanto a los efectos genotóxicos, el porcentaje de aberraciones cromosómicas observadas en los puntos de muestreo fue inferior al 1%, mientras que en el grupo control no se detectaron aberraciones cromosómicas (Tabla 2). En este sentido, se han observado diferencias muy fuertes entre los grupos (X2 (2) = 15,11, P = 5,25*10-4). Mediante la prueba de Dunn, se identificaron diferencias notables entre el grupo control y los puntos del arroyo, encontrando evidencia moderadamente fuerte para respaldar las diferencias con el punto EG (Δ x̄ = -2.290, P = 0.033), así como evidencia muy fuerte con el grupo SG (Δ x̄= -3,870, P= 2*10-4).
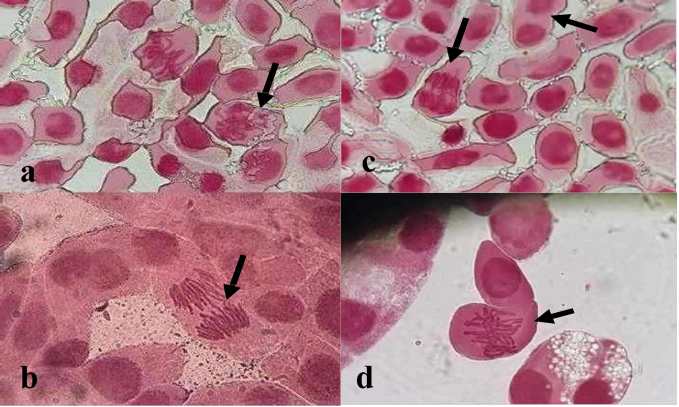
Figura 2. Aberraciones cromosómicas observadas en células germinativas de Allium cepa (1.000x), expuestas a las aguas del arroyo Guazú. Referencia: (a) C-metafase, (b) Puentes cromosómicos en anafase, (c) Cromosomas errantes y células binucleadas, (d) C-Metafase.
En este sentido, las aberraciones cromosómicas identificadas en los puntos EG y SG incluyeron puentes cromosómicos, cromosomas errantes, c-metafase y cromosomas pegajosos. (Figura 2), por lo que hubo un efecto genotóxico de las aguas del arroyo Guazú en células meristemáticas de raicillas de A. cepa, expuestas por 24 horas.
Discusión
En un análisis de calidad de agua de cualquier tipo, y más aún en el de aguas superficiales, uno de los parámetros más importantes es el oxígeno disuelto, que indica la capacidad de autodepuración de corrientes superficiales. Cuando los valores de oxígeno disuelto se mantienen en niveles óptimos y cuyo descenso constituye un primer indicador de contaminación orgánica (de la tasa de degradación de sustancias orgánicas e inorgánicas susceptibles de ser oxidadas) (Raffo Lecca y Ruiz Lizama, 2014). En este caso, se observaron niveles por debajo de los límites < 5 mgO2.L-1 según la Resolución Nº 222 y, sumado a los valores elevados de la DBO5, indicarían una exigencia anormal en el consumo de oxígeno en el arroyo para poder transformar materias orgánicas ya que, a mayor cantidad de materia orgánica contenida en una muestra de agua, se requiere más cantidad de oxígeno para que los microorganismos pueden degradarla (Raffo Lecca y Ruiz Lizama, 2014). Por tanto, estos resultados indican que la contaminación del arroyo Guazú son de origen domiciliario, de residuos sólidos y orgánicos, tal como lo reportaron Castañón González y Abraján Hernández (2009) y López Arias et al. (2021).
Contaminantes como los metales pesados pueden afectar a los organismos desde niveles moleculares hasta comunidades ocasionando cambios nocivos en el organismo, dependiendo de su grado de exposición (efectos agudos y/o crónicos) (Castillo Morales, 2004; Kunc et al., 2016). Para la evaluación de los efectos genotóxicos se utilizó el ensayo en Allium cepa. En la evaluación realizada, se ha llegado a observar anomalías cromosómicas tales como, células binucleadas, c-mitosis, puentes cromosómicos y cromosomas errantes, como descrito por Bonciu et al. (2018). Estas anomalías surgen como consecuencia de daños en el ADN, inhibición de la síntesis y replicación del ADN o fallos en los mecanismos de control celular (Beltrán y Gonza, 2017).
Analizando el índice mitótico, los valores en el grupo control son levemente más elevados, mientras que más bajos en cuanto a la exposición de las aguas contaminadas, situación similar a lo reportado por López Arias et al. (2016) y Beltrán y Gonza (2017) en otros ambientes acuáticos impactados similares al arroyo Guazú. Esto podría indicar un leve efecto citotóxico ya que estadísticamente se encontró una evidencia muy débil a pesar de que no se detectaron concentraciones de metales pesados en el presente estudio, lo cual es llamativo dado el hecho de que entre ambos puntos del arroyo existen curtiembres que desechan sus efluentes al cuerpo de agua. Sin embargo, si se encontraron una fuerte evidencia de efectos genotóxicos sobre las raíces de Allium cepa. Esto podría deberse a que tal vez hubo algún componente no determinado en el estudio que podría haber ocasionado los efectos genotóxicos. Considerando que los resultados obtenidos fueron en una estación (primavera), se podría realizar otros muestreos en las demás estaciones del año para observar si estos efectos citotóxicos persisten o no, ya que la estacionalidad puede influenciar sobre la exposición a agentes contaminantes emergentes (Manzano-León et al., 2016). A su vez, sería conveniente realizar un monitoreo en el arroyo para caracterizar la comunidad biológica de los mismos, realizar otros ensayos, por ejemplo, en los peces como Danio rerio, que son excelentes indicadores para evaluar los efectos citotóxicos y genotóxicos de contaminantes a largo plazo, ya que pueden absorber los efectos tóxicos en diferentes órganos (Govind y Madhuri, 2014).
Conclusiones
Con base a los resultados obtenidos se concluye que hay efectos citotóxicos y genotóxicos de las aguas del arroyo Guazú, sin embargo, estos efectos son mínimos. Si bien se identificaron anomalías cromosómicas tales como cromosomas rezagados, C-metafase, células binucleadas y puentes cromosómicos, es necesario continuar con los monitoreos para determinar si estos efectos persisten a lo largo del tiempo dado a que es un trabajo preliminar. Por lo tanto, es conveniente incorporar otros puntos de muestreo, ampliar el listado de parámetros a ser determinados o compararlos con otros cursos de agua sometidos a diferentes presiones antrópicas para evaluar si los contaminantes urbanos producen efectos citotóxicos y genotóxicos. A su vez, dado que las aguas del arroyo Guazú presentan una elevada carga orgánica de contaminación acuática, se deben evaluar su potencial citotóxico y genotóxico sobre la comunidad local, por ejemplo, los peces y compararlos con otros organismos indicadores, a fin de definir políticas públicas para la disminución de la contaminación acuática en el arroyo Guazú.
Agradecimientos: Al Lic. Alfredo Andrés Acosta por el apoyo logístico (transporte y muestreo) y al laboratorio de calidad de aguas del CEMIT-DGICT por los análisis fisicoquímicos.
Contribución de autores: Conceptualización: G.V., E.A.L.S.; Curación de datos: G.V., E.A.L.S.; Análisis formal: G.V., E.A.L.S.; Adquisición de fondos: G.V. ;Investigación: M. E. V., M.M., M.C.; Metodología: G.V., E.A.L.S., G.A.; Administración del Proyecto: G.V.; Recursos: G.V., E.A.L.S. ; Software: ; Supervisión: G.V., E.A.L.S.; Validación: G.V., E.A.L.S. ; Visualización: G.V.; Redacción-borrador original: G.V., E.A.L.S., G.A.; Redacción-revisión y edición: G.V., E.A.L.S.
Fuente de Financiamiento: El presente trabajo fue financiado a través de los Fondos del Rectorado (FIR) de la Universidad Nacional de Asunción (2023).
Disponibilidad de datos: Los datos utilizados en esta investigación podrán ser solicitados al autor de correspondencia según pertinencia.
Referencias Bibliográficas
APHA/AWWA/WEF. (2023). Standard Methods for the Examination of Water and Wastewater. In American Public Health Association (Ed.). Standard Methods. 24 edition. Washington, pp. 1618.
Beltrán, R., y Gonza, K. (2017). Cytotoxicity and genotoxicity of the waters of the Jequetepeque and Moche rivers in the environmental bioindicator Vicia faba L. Scientia Agropecuaria, 8 (3), 203-213. https://doi.org/10.17268/sci.agropecu.2017.03.03
Blattner, G., Cavazza, A., Thrasher, A. J., & Turchiano, G. (2020). Gene editing and genotoxicity: targeting the off-targets. Frontiers in Genome Editing, 2, 613252.
Bonciu, E., Firbas, P., Fontanetti, C. S., Wusheng, J., Karaismailoğlu, M. C., Liu, D., Menicucci, F., Pesnya, D. S., Popescu, A., Romanovsky, A. V., Schiff, S., Slusarczyk, J., Souza, C. P. de, Srivastava, A., Sutan, A., y Papini, A. (2018). An evaluation for the standardization of the Allium cepa test as cytotoxicity and genotoxicity assay. Caryologia, 71(3), 191-209.
Camargo, J. A., y Alonso, A. (2007). Contaminación por nitrógeno inorgánico en los ecosistemas acuáticos: problemas medioambientales, criterios de calidad del agua, e implicaciones del cambio climático. Ecosistemas, 16 (2), 1–13.
Carolin, C. F., Kumar, P. S., Saravanan, A., Joshiba, G. J., y Naushad, M. (2017). Efficient Techniques for the Removal of Toxic Heavy Metals from Aquatic Environment : A Review. Environmental Chemical Engineering, 5 (3), 2782–2799. https://doi.org/10.1016/j.jece.2017.05.029
Carvalho Batista, N. J., de Carvalho Melo Cavalcante, A. A., Geci de Oliveira, M., Nascimento Medeiros, E. C.,Machado, J. L., Ribeiro Evangelista, S., Dias, J., dos Santos, C., Duarte, A., da Silva, F. R., y da Silva, J. (2016). Genotoxic and mutagenic evaluation of water samples from a river under the influence of different anthropogenic activities. Chemosphere, 164, 134–141. https://doi.org/10.1016/j.chemosphere.2016.08.091
Castillo Morales, G. (2004). Ensayos Toxicológicos y Métodos de Evaluación de Calidad de Aguas. Estandarización, intercalibración, resultados y aplicaciones. Volumen 1. Canadá. IDRC
Dunn, O. J. (1961). Multiple comparisons among means. Journal of the American Statistical Association, 56(293), 52–64. https://doi.org/10.1080/01621459.1961.10482090
Fiskesjö, G. (1985). The Allium test as a standard in environmental monitoring. Hereditas, 102(1), 99–112. https://doi.org/10.1111/j.1601-5223.1985.tb00471.x
Castañón González, J. H., y Abraján Hernández, P. (2009). In Análisis de la calidad del agua superficial del río Sabinal, Tuxtla Gutiérrez, Chiapas, México. Revista Ciencias UNICACH, 3 (2), 67-77
Govind, P., y Madhuri, S. (2014). Heavy metals causing toxicity in humans, animals and environment. Research Journal of Animal, Veterinary and Fishery Sciences, 2 (2), 17–23.
Herrero, O., Martín, J. P., Freire, P. F., López, L. C., Peropadre, A., & Hazen, M. J. (2012). Toxicological evaluation of three contaminants of emerging concern by use of the Allium cepa test. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 743 (1-2), 20-24.
Kassa, B. A. (2021). Cytotoxicity and Genotoxicity evaluation of municipal wastewater discharged into the head of Blue Nile River using the Allium cepa test. Scientific African, 13, e00911.
Khatri, N., y Tyagi, S. (2015). Influences of natural and anthropogenic factors on surface and groundwater quality in rural and urban areas. Frontiers in Life Science, 8(1), 23–39. https://doi.org/10.1080/21553769.2014.933716
Kruskal, W. H., & Wallis, W. A. (1952). Use of ranks in one-criterion variance analysis. Journal of the American Statistical Association, 47 (260), 583–621. https://doi.org/10.1080/01621459.1952.10483441
Kunc, H. P., McLaughlin, K. E., y Schmidt, R. (2016). Aquatic noise pollution: Implications for individuals, populations, and ecosystems. Proceedings of the Royal Society B: Biological Sciences, 283(1836). https://doi.org/10.1098/rspb.2016.0839
Leme, D. M., y Marin-Morales, M. A. (2007). Chromosome aberration and micronucleus frequencies in Allium cepa cells exposed to petroleum polluted water--a case study. Mutation Research, 650(1), 80-86.
Leme, D. M., y Marin-Morales, M. A. (2009). Allium cepa test in environmental monitoring: A review on its application. Mutation Research - Reviews in Mutation Research, 682(1), 71–81. https://doi.org/10.1016/j.mrrev.2009.06.002
Lionetto, M. G., Caricato, R., y Giordano, M. E. (2021). Pollution Biomarkers in the Framework of Marine Biodiversity Conservation: State of Art and Perspectives. Water, 13(13), 1847.
Londoño Franco, L. F., Londoño Muñoz, P. T., y Muñoz Garcia, F. G. (2016). Los riesgos de los metales pesados en la salud humana y animal. Biotecnología En El Sector Agropecuario y Agroindustrial, 14(2),145-153. doi: 10.18684/BSAA(14)145-153
López Arias, T., Fernández Peralta, V., Franco de Diana, D., Galeano Delgado, E., López Vera, M. E., Ímas Ayala, H., Bobadilla Giménez, N., Benítez Resquín, L. M., y Mazó Bareiro, C. G. (2016). Índices de calidad ambiental de aguas del Arroyo Caañabe mediante tests microbiológicos y ecotoxicológico. Ambiente & Água, 11(3), 549–565. doi: 10.4136/ambi-agua.1703
López Arias, T. R., Villalba Duré, G., Policani Barrios, M. D., Bogarín Cantero, B. C., y Mendoza, A. E. (2021). Calidad de agua del Arroyo Guazú del Departamento Central evaluada mediante indicadores biológicos, parámetros fisicoquímicos y ecotoxicológicos. Investigaciones y Estudios- UNA, 12(1), 4–18.https://doi.org/10.47133/ieuna2111
Ministerio del Ambiente y Desarrollo Sostenible. (2002). Resolución N° 222/02 “Por la cual se establece el padrón de calidad de las aguas en el territorio nacional”. Asunción. MADES
Ministerio del Ambiente y Desarrollo Sostenible. (2006). Resolución N° 255/06 “Por la cual se establece la clasificación de las aguas superficiales de la República del Paraguay”. Asunción. MADES
Manzano-León, N., Serrano-Lomelin, J., Sánchez, B. N., Quintana-Belmares, R., Vega, E., Vázquez- López, I., Rojas Bracho, L., López Villegas, M. T., Vadillo-Ortega, F., Vizcaya Ruiz, A. de, Perez, I. R., O´Neill, M. S. y Osornio-Vargas, A. R. (2016). TNF α and IL-6 responses to particulate matter in vitro: variation according to PM size, season, and polycyclic aromatic hydrocarbon and soil content. Environmental health perspectives, 124(4), 406-412.
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., Minchin, P. R., O´Hara, R. B., Simpson, G. L., Solymos, P., Stevens, M. H., Szoecs, E., y Wagner, H. (2019). Vegan: Community Ecology Package. R package version 2.5-6. In Community Ecology Package (2.5-6), p. 285.
Radić, S., Stipaničev, D., Vujčić, V., Rajčić, M. M., Širac, S., & Pevalek-Kozlina, B. (2010). The evaluation of surface and wastewater genotoxicity using the Allium cepa test. Science of the Total Environment, 408(5), 1228-1233.
Raffo Lecca, E., y Ruiz Lizama, E. (2014). Caracterización de las aguas residuales y la demanda bioquímica de oxígeno Industrial Data. Universidad Nacional Mayor de San Marcos Lima, Perú. Industrial Data, 17(1), pp. 71-80.
Rodríguez Soto, J. C. (2018). Citotoxicidad y genotoxicidad de nanopartículas de oro sintetizadas por ablación láser sobre Allium cepa L. (Amaryllidaceae). Arnaldoa, 25(3), 1015–1026. https://doi.org/10.22497/arnaldoa.253.25313
Sabeen, M., Mahmood, Q., Ahmad Bhatti, Z., Faridullah, Irshad, M., Bilal, M., Hayat, M. T., Irshad, U., Ali Akbar, T., Arslan, M., y Shahid, N. (2020). Allium cepa assay based comparative study of selected vegetables and the chromosomal aberrations due to heavy metal accumulation. Saudi Journal of BiologicalSciences, 27(5), 1368–1374. https://doi.org/10.1016/j.sjbs.2019.12.011
