Sección: Artículo original
*Autor correspondiente:
jbenitez@rec.una.py
Editor de área:
Patricia
Criscioni![]() , Universidad
Nacional de Asunción (UNA), Facultad de Ciencias Veterinarias. San Lorenzo,
Paraguay.
, Universidad
Nacional de Asunción (UNA), Facultad de Ciencias Veterinarias. San Lorenzo,
Paraguay.
Recibido:
23 de agosto de 2024
Revisado:
06 de octubre de 2024
Aceptado:
18 de octubre de 2024
Recibido en versión modificada:
04 de diciembre de 2024
Este
es un artículo publicado en acceso abierto bajo una Licencia Creative Commons “CC BY 4.0”. ![]()
Declaración de conflicto: Los autores declaran no tener conflicto de intereses.
e-ISSN 2709 -0817
Como citar: Riveros Pineda, M. E., Benítez Núñez, J. V., Zelada Cardozo, N. de J., Valdez Borda, M. E. y Morínigo Céspedes, F. M. (2024). Propagación asexual de Jaguareté Ka´a (Baccharis trimera Less. DC) con diferentes concentraciones de ácido indolbutírico (AIB). Revista investigaciones y estudios – UNA, 15(2), pp. 80-92.
Propagación asexual de Jaguarete Ka´a (Baccharis trimera Less. DC) con diferentes concentraciones de ácido indolbutírico (AIB)
Asexual propagation of Jaguarete ka'a (Baccharis trimera Less. DC) with different concentrations of indolebutyric acid (IBA)
María Esther Riveros Pineda1![]() , Juan Venancio Benítez Núñez1*
, Juan Venancio Benítez Núñez1*![]() , Natalia de Jesús Zelada Cardozo2
, Natalia de Jesús Zelada Cardozo2![]() , Magalí Elizabeth Valdez Borda1
, Magalí Elizabeth Valdez Borda1![]() , Fernando Mathías Morínigo Céspedes1
, Fernando Mathías Morínigo Céspedes1![]()
1 Universidad Nacional de Asunción. Centro Multidisciplinario de Investigaciones Tecnológicas. San Lorenzo, Paraguay.
2 Universidad Nacional de Asunción. Facultad de Ciencias Agrarias. San Lorenzo, Paraguay.
Resumen. El Jaguarete ka’a es una especie medicinal de sabor amargo, popularmente utilizado para aliviar trastornos gástricos, además, se encuentra en vulnerable estado de conservación. La multiplicación asexual por medio de esquejes es una alternativa que mantiene las características agronómicas deseables. El objetivo de esta investigación fue evaluar la multiplicación asexual de Jaguarete ka’a con diferentes concentraciones de ácido indolbutírico (AIB). El ensayo se llevó a cabo en la División de Floricultura y Plantas Medicinales del Área de Producción Agrícola de la Facultad de Ciencias Agrarias, Universidad Nacional de Asunción (FCA, UNA). El diseño empleado fue completamente al azar, compuesto por cinco tratamientos (0 ppm, 500 ppm, 1000 ppm, 1500 ppm y 2000 ppm) y cuatro repeticiones, totalizando 20 unidades experimentales y cada unidad experimental estuvo compuesta por 6 esquejes. Las variables evaluadas fueron: porcentaje de enraizamiento, número de raíces y brotes. Todas las medias fueron sometidas al análisis de varianza (ANAVA) y comparadas por el Test de Tukey al 5%. Los resultados indican que a concentraciones de 2000 ppm de la hormona AIB se obtuvo mayor número de raíces, pero no hubo efecto significativo en el porcentaje de enraizamiento y número de brotes de Jaguarete ka’a.
Palabras clave: brotes, esquejes, enraizamiento.
Abstract. Jaguarete ka'a is a medicinal species with a bitter taste, popularly used to relieve gastric disorders, and it is in a vulnerable state of conservation. Asexual multiplication through cuttings is an alternative that maintains the desirable agronomic characteristics. The objective was to evaluate the asexual multiplication of Jaguarete ka'a with different concentrations of indolebutyric acid (IBA). The trial was carried out in the Division of Floriculture and Medicinal Plants of the Agricultural Production Area of the Faculty of Agrarian Sciences, UNA. The design used was completely randomized, composed of five treatments (0 ppm, 500 ppm, 1000 ppm, 1500 ppm and 2000 ppm) and four repetitions, totaling 20 experimental units and each experimental unit was composed of 6 cuttings. The variables evaluated were: rooting percentage, number of roots and shoots. All means were subjected to the analysis of variance (ANAVA) and the means were compared by the Tukey Test at 5%. The results indicate that at concentrations of 2000 ppm of the AIB hormone, a greater number of roots was obtained, but there was no effect on the percentage of rooting and number of shoots of Jaguarete ka'a.
Keywords: shoots, cuttings, rooting.
Introducción
El Jaguarete ka’a o Carqueja (Baccharis trimera Less. DC.) es un arbusto dioico, ramoso, perteneciente a la familia de las compuestas que llega hasta los 1,5 metros de altura. El Jaguarete ka’a es nativa de Sudamérica y crece en forma silvestre en suelos arenosos, rocosos en Paraguay, sur de Brasil, Uruguay y norte y centro de Argentina (Candia Román, 2008).
La importancia de esta especie radica por su uso medicinal, la parte aérea en infusión se usa como digestivo y para problemas estomacales. También se toma en el mate (Vera Jiménez, 2009). Según Bona et al. (2002) menciona que la multiplicación del Jaguarete ka’a ocurre naturalmente por medio de las semillas que son dispersadas por el viento, las semillas son viables pero el mayor inconveniente es la alta variabilidad que existe en la descendencia, además es una especie que según la resolución (SEAM N° 524/2006) se encuentra en estado vulnerable de conservación (Pin et al., 2009). El uso medicinal de la especie implica la remoción de las raíces y esta modalidad de uso netamente extractiva determinan la pérdida del recurso genético en las poblaciones naturales nativas (Díaz Gabutti et al., 2018). Por esa razón se recomienda mantener las características deseables y propagar masivamente, mediante la propagación por esquejes.
La propagación vegetativa por esquejes se emplea con mayor frecuencia debido a que acelera el crecimiento y desarrollo de las plantas, además se garantiza una mayor estabilidad genética, la cual se verá reflejada en una buena producción y rentabilidad del cultivo (Garbanzo et al., 2021). También, es una metodología sencilla de bajo costo que puede contribuir a disminuir y evitar la presión sobre las poblaciones naturales (Dirchwolf y Schroeder, 2015). Se debe considerar la calidad de la planta madre, siendo necesario un óptimo estado sanitario y nutricional. Además, el material proveniente de las plantas jóvenes tiene una mejor potencialidad rizogénica (Barba et al., 2014); razón por la cual se debe contar con métodos de propagación que permitan obtener plantas en forma rápida y simple (Dirchwolf y Schroeder, 2015).
La técnica de propagación por esquejes es una alternativa para la especie, pero el problema que existe es la dificultad en el enraizamiento, por lo tanto, se recurre a la aplicación de hormonas que ayudan a inducir la formación de raíces. Entre los reguladores del crecimiento que promueven y aceleran la formación de raíces en las plantas se encuentra el ácido indolbutírico (AIB), el cual ha sido ampliamente utilizado para la propagación de esquejes o estacas y acodos (Paredes-Suárez et al., 2021). Es fitorregulador auxínico, muy usado para estimular la formación de raíces, así también por su estabilidad, ya que es muy resistente a la oxidación por la luz, enzimas u otros agentes (Hartmann y Kester, 2005).
Por otra parte, los efectos positivos del tratamiento de esquejes con fitoreguladores de crecimiento exógenos han sido ampliamente comprobados en diversas especies como el typycha Kuratu (Boggino, 2001), menta arvensis (Benítez, 2014), cedrón (Oyanadel, 2002), Ka'a He'ê (Paredes-Suárez et al., 2021) y lavanda (De Bona et al., 2012), consideradas como medicinales y aromáticas (López et al., 2008).
Por todo lo mencionado, el objetivo de este trabajo fue evaluar la multiplicación asexual de Jaguarete ka’a con diferentes concentraciones de ácido indolbutírico (AIB).
Materiales y Métodos
El experimento se llevó a cabo en la División de Floricultura y Plantas Medicinales del Área de Producción Agrícola de la Facultad de Ciencias Agrarias, de la Universidad Nacional de Asunción (FCA, UNA) ubicado en el Campus Universitario en la ciudad de San Lorenzo del Departamento Central, entre las coordenadas geográficas 25°20'15,4" de latitud sur y 57°30'58,8" de longitud oeste, entre los meses de mayo a julio del 2024.
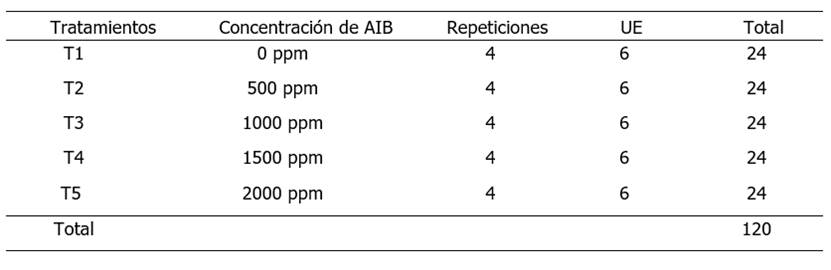
El diseño experimental utilizado fue completamente al azar (DCA), los tratamientos consistieron en cuatro concentraciones de ácido indolbutírico (AIB) y un testigo absoluto. Ver descripción de los tratamientos en la Tabla 1. [0 ppm (T1), 500 ppm (T2), 1000 ppm (T3), 1500 ppm (T4) y 2000 ppm (T5)]. Obteniendo un total de 5 tratamientos y 4 repeticiones, totalizando 20 unidades experimentales (UE). Cada unidad experimental estuvo compuesta por seis esquejes, utilizando un total de 120 esquejes de Jaguarete ka’a.
Tabla 1. Descripción de los tratamientos para la propagación asexual de Jaguarete ka’a
En invernadero, se procedió a realizar cortes basales debajo del entrenudo de cada esqueje, el tamaño de los esquejes fue de 12 cm de longitud con 5 a 6 nudos, aproximadamente (Figura 1), las cuales fueron colocadas en un recipiente con agua de grifo para evitar la desecación durante su manipulación, posteriormente fueron expuestas la parte basal en las distintas concentraciones de Ácido Indolbutírico (Sigma®, USA), durante 10 segundos y después los esquejes fueron introducidos en cada tubete de color con una longitud de 12 cm y una capacidad de 53 cm3, todos los tubetes contenían compost y arena gorda en una relación 1:1. Los esquejes fueron distribuidos de acuerdo a cada tratamiento por repetición bajo la técnica del micro túnel para su protección temporal.

![]()
Figura 1. Ilustración del proceso de implantación del experimento: A) Planta madre. B) Esquejes cortados de Jaguarete ka`a con 12 cm de longitud. C) Exposición al ácido indolbutírico (AIB) durante 10 segundos. D) Esquejes con ácido indolbutírico separados por tratamiento.
La evaluación se realizó a los 30 días, se extrajeron los esquejes de los tubetes, teniendo en cuenta las siguientes variables: se contabilizaron el número de raíces y números de brotes por esqueje, el porcentaje de esquejes para lo cual se consideraron la totalidad de los esquejes enraizados de cada repetición correspondiente a cada tratamiento y luego fue determinado por la siguiente formula:
 |
La validación de los resultados de realizó por medio del análisis de varianza, con un nivel de significancia de 5 % y las diferencias significativas determinadas por la prueba de Tukey al 5 % de probabilidad de error, sometidos al programa estadístico infostat 2020 (Di Rienzo et al., 2020).
Resultados y Discusión
En la Tabla 2 se puede verificar los promedios obtenidos en el porcentaje de enraizamiento, número de brotes y raíces.
Tabla 2. Valores promedios de porcentaje de enraizamiento, número de raíces y brotes. San Lorenzo. 2024.
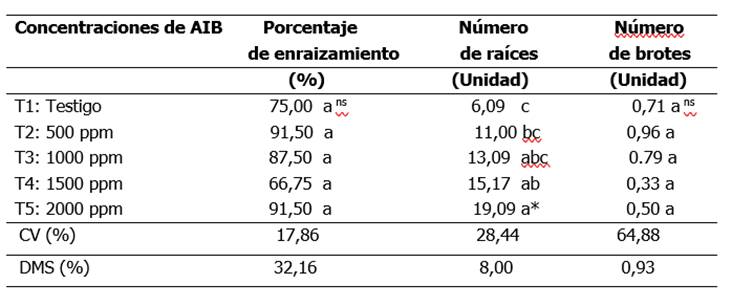 |
* Significativo por el ANAVA. Las medias con letras diferentes en las columnas, indican diferencia significativa entre sí al 5% por el test de Tukey. ns= no significativo. CV: coeficiente de variación. DMS: diferencia mínima significativa.
Los resultados obtenidos a los 30 días en el porcentaje de enraizamiento en esquejes de Jaguarete ka`a para los diferentes tratamientos, se pueden observar en la Figura 2.
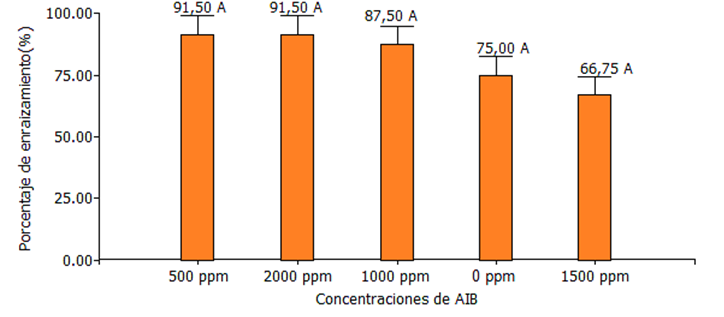
Figura 2. Medias de porcentaje de enraizamiento de Jaguarete ka`a, evaluación realizada a los 30 días después del establecimiento del experimento. FCA-UNA, San Lorenzo. Paraguay, 2024.
En cuanto al porcentaje de enraizamiento se puede observar en la figura 2, que no presentó diferencias estadísticas significativas entre los tratamientos.
Los resultados obtenidos concuerdan con Cabello y Salas Pino (2004), donde los esquejes tratados con AIB, al igual que los no tratados, tuvieron altos porcentajes de enraizamiento mayores a 86,6 %, porcentaje que corresponde al testigo. El más alto porcentaje de enraizamiento de los esquejes se logró con la dosis más elevada 1000 mg L-1 con un porcentaje de 98,2%, pero no hubo diferencia significativa en relación al testigo. Explican que puede deberse a que las alas del jaguarete ka'a funcionan como una hoja verdadera y se sabe que las hojas y las yemas contienen auxinas, carbohidratos y de cofactores que translocados a la zona de corte que está en contacto con el sustrato, inducen a la formación de raíces en el esqueje.
La falta de respuesta a la aplicación de la auxina sintética puede deberse a que estas especies poseen suficiente cantidad de auxina natural para promover el enraizamiento, tal como lo explica Hartman y Kester (1996), pudiendo incluirse a estas especies dentro del grupo de fácil enraizamiento.
El efecto también fue observado en las evaluaciones reportadas en Typycha Kuratu por Boggino (2001), confirma que en todos los casos no hubo aumento significativo en el porcentaje de estacas enraizadas, además Taiz y Zeiger (2006) reportaron que las células de la raíz suelen contener auxina suficiente o casi suficiente para la elongación normal y asimismo concuerda con Rastogui et al. (2013), quienes refieren que la aplicación exógena de auxinas alrededor de las raíces inhibió el crecimiento después de la aplicación de los tratamientos.
Igualmente, Oyanadel (2002), trabajando sobre el efecto del ácido indolbutírico sobre el crecimiento aéreo en Cedrón (Aloysia triphylla), encontró que el porcentaje de enraizamiento de cedrón no presentó diferencias significativas, observándose el porcentaje de enraizamiento un promedio de 50,7 %, encontrándose altos valores con concentraciones de 250 y 500 ppm con sus respectivos valores de 51,7 y 73,3 % y la concentración de 500 ppm obtuvo un porcentaje menor de 30 %, obteniendo los mejores resultados a concentraciones bajas de AIB (125 y 250 ppm). Asimismo, Silva et al. (2007), mencionan en mini estacas de Jatropha curcas L., el testigo presentó el mayor porcentaje de enraizamiento en comparación con las concentraciones de 250 mg kg-1, 500 mg kg-1 y 1000 mg kg-1 de AIB.
De manera similar Benítez (2014), trabajando en el enraizamiento de Mentha arvensis L. sobre la interacción de ácido indol butírico (AIB), menciona que no hubo diferencia significativa con respecto al uso de AIB en el porcentaje de enraizamiento, con la aplicación de AIB obtuvo un porcentaje mayor de 96,13% y sin la aplicación con un porcentaje menor a 91,13% respectivamente. Sin embargo, este efecto no fue similar a los resultados obtenidos por Paredes-Suárez et al. (2021), evaluando el efecto de AIB en mini esquejes de Stevia rebaudiana, mostraron que con 3 mg L-1 de AIB se logró obtener el 100 % de los mini esquejes con raíces, mientras que con 1,5 y 2,5 mg L-1 se obtuvo un 90 % en comparación con el testigo, donde sólo el 50 % de los explantes presentaron algunas pequeñas raíces.
Por otro lado Salas y Laviosa (1998), evaluando el efecto del ácido indolbutírico en estacas terminales con hojas de yerba mate a los 47 días después de la aplicación de los tratamientos, la aplicación terminal de AIB en la dosis de 1000 mg L-1 promovió el mayor porcentaje de enraizamiento (86 %) de las estacas terminales con hojas de yerba mate, superando significativamente al testigo (66 %) y a los tratamientos basales de 250 y 1000 mg L-1 de AIB, que obtuvieron 69 % y 61 % de enraizamiento, respectivamente; mas no presentó diferencias significativas con los tratamientos basales de 500 mg L-1 de AIB (79 %) y 750 mg L-1 de AIB (79 %).
De la misma forma Oliveira et al. (2011), observaron que en las estacas apicales y subapicales de Hyptis leucocephala y estacas basales de Hyptis platanifolia la dosis más alta de AIB (4000 mg L-1), fue la que presentó los mejores porcentajes de enraizamiento y concluyeron que el uso de concentraciones de 2000 a 4000 mg L-1 de AIB son apropiadas para la propagación vegetativa de esas especies. También Solís et al. (2015), en la propagación asexual de azul de mata por medio de estacas, encontraron que hubo efecto significativo de la dosis de AIB en los porcentajes enraizados, siendo 1000 ppm el que presentó el mayor porcentaje 69%.
Ruiz y Mesén (2010), mostraron que el mayor porcentaje de enraizamiento se obtuvo con la dosis de 0,15 % de AIB (92,6 %), aunque no difirió significativamente de las dosis de 0,20 % y 0,10 % (porcentajes de enraizamiento de 87,7 % y 80,3 %, respectivamente). Estos tratamientos fueron estadísticamente superiores al testigo con un porcentaje menor de 45,7%.
En lo que respecta al porcentaje de enraizamiento, en los resultados obtenidos por De Bona et al. (2012) determinaron que la adicción de dosis AIB no generó efecto en el desarrollo de raíces adventicias en estacas de Lavandula angustifolia en relación al testigo. La adición exógena de auxinas ayuda a inducir rizogénesis adventicias obteniendo respuestas favorables, el efecto depende de la especie, genotipo, sustrato, tipo de estaca y de las concentraciones endógenas de las hormonas de estas plantas.
Por el contrario, Tejada et al. (2019), evaluando el efecto de concentraciones de AIB en el porcentaje de enraizamiento de arándano, evidenciaron que las distintas concentraciones de 100 y 200 mg L-1 tuvieron los mayores porcentajes, difiriendo de los demás tratamientos restantes.
Los reguladores de crecimiento participar en varios procesos morfogenéticos y de crecimiento; además, dependiendo de su concentración, la misma hormona puede ser estimulatoria o inhibitoria de una misma respuesta. Audesirk et al. (2008) indicaron que las auxinas promueven el alargamiento de las células y en concentraciones bajas estimulan la rizogénesis, mientras que una concentración alta lo inhibe.
Las variaciones significativas en el porcentaje de enraizamiento, evidencian respuestas diferenciales respecto a las concentraciones de regulador de crecimiento. En ese contexto, las dosis más optimas se encontraron entre el rango de 100 a 200 mg L-1 de AIB. Castro y Álvarez (2013) en el enraizamiento ex vitro de Vaccinium a dosis de mg L-1, resaltaron que cada variedad, cultivar o genotipo expresa distinta reacción bajo ciertas concentraciones de fitohormonas.
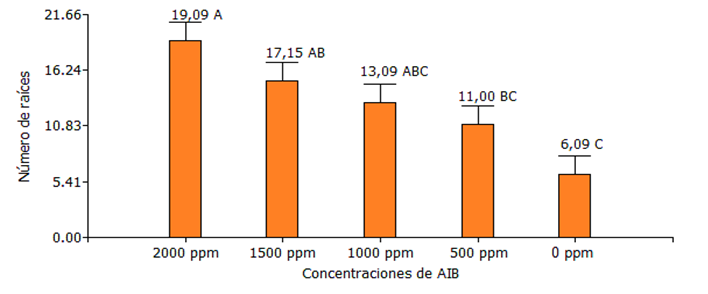
Figura 3. Medias de número de raíces de Jaguarete ka`a, evaluación realizada a los 30 días después del establecimiento del experimento. FCA-UNA, San Lorenzo. Paraguay, 2024.
En cuanto al número de raíces en la figura 3 se puede apreciar que hubo diferencia significativa entre las medias obtenidas, con el aumento de las concentraciones de AIB también incremento el número de raíces, siendo la aplicación de 2000 ppm la que obtuvo el mayor valor con 19,09 de raíces comparado con el tratamiento sin aplicación de AIB (0 ppm) y la concentración de 500 ppm que resultaron inferiores.
Según los resultados de la presente investigación no fueron similares a lo mencionado por Cabello y Salas (2004), sobre la aplicación de dosis crecientes de ácido-3-indol butírico en el jaguarete ka`a, describen que desde 250 mg L-1 hasta 1000 mg L-1, no incrementó el número de raíces de los esquejes enraizados, siendo que las diferencias estadísticas no fueron significativas. Se observó que, en valores absolutos, la respuesta a la aplicación de las diferentes dosis de AIB sigue una relación inversa: a mayor dosis menor número de raíces. Estos resultados son distintos a los obtenidos en este experimento. A su vez, este patrón de respuesta ha sido encontrado en gran cantidad de otras especies (Hartmann y Kester 1996), donde normalmente se da un aumento en la capacidad de enraizamiento al aumentar la dosis de auxina hasta alcanzar un óptimo, a partir del cual cualquier aumento en dosis de auxina resulta por el contrario en una disminución en el enraizamiento debido a los efectos tóxicos de la sobredosis. Como se ha indicado, los efectos positivos de las auxinas en el enraizamiento han sido asociados a sus efectos sobre la división celular, el aumento de transporte de carbohidratos y otros cofactores foliares a los sitios de aplicación, así como a la estimulación en la síntesis de ADN en las células tratadas.
Por otra parte, el trabajo mencionado por Ruiz et al. (2005) en el efecto del ácido indolbutírico (AIB) de Gmelina arbórea, indican que el número de raíces emitidas por las estacas fue significativamente mayor en los tratamientos con AIB. También Latsague et al. (2008), quien sostiene que al incrementar paulatinamente las dosis de IBA, se obtiene un aumento en el número de raíces en estacas de Berberidopsis corallina. De tal manera Ringphawan y Pauline (2019), explican que la generación de raíces abundantes y uniformes es indicador de la influencia del ácido indolbutírico debido a que la concentración endógena de auxinas de los cladodios se encuentra en un nivel inferior, por tanto, la aplicación exógena del ácido indolbutírico (AIB), favorece considerablemente al enraizamiento.
De acuerdo López et al. (2020), con respecto al número de raíces, el análisis de varianza realizado arrojó diferencias significativas entre las distintas concentraciones hormonales ensayadas. Donde Codiaeum variegatum produjo raíces, incluso sin necesidad de aplicar AIB. Silva et al. (2007), reportan índices satisfactorios de enraizamiento en estacas de Jatropha curcas sin algún tratamiento.
Repuesta similar obtuvieron Paredes-Suárez et al. (2021), la aplicación de AIB tuvo un efecto significativo en cuanto al número de raíces en los esquejes apicales de la stevia. El mayor número de plantas con raíces de 6,8 se obtuvo con 3,0 mg L-1 de AIB, mostrando que meristemos apicales de stevia pueden originar una planta independiente, seguido de la concentración de 1,5 mg L-1 de AIB, con lo que se generaron 5,4 de raíces por brote, en comparación con el testigo.
Así mismo Ruiz y Mesén (2010), en cuanto al número promedio de raíces por estaquilla en el enraizamiento de sacha inchi, mostró la típica tendencia creciente al aumentar la dosis de AIB, a una dosis de 0,20 % se obtuvo un promedio mayor de 25,9 de raíces. A su vez Balaguera et al. (2010), sostienen que al emplear menores concentraciones (0, 1,500, 3,000 mg L-1) de AIB en la propagación pitahaya, no evidencian diferencias significativas para cada uno de los tratamientos. Por lo tanto, un buen balance hormonal entre la cantidad y disposición de AIB en el tejido vegetal, estimulan la elongación de células específicas e inhiben el crecimiento de otras (Díaz, 2016).
También Tejada et al. (2019), en referencia al número de raíces registraron diferencias significativas para las distintas dosis de AIB, se observa que el mayor número de raíces se alcanzó a una concentración de 200 mg L-1 con una media de 5 raíces por planta, a estos resultados le siguieron el efecto obtenido a concentración de 100 mg L-1 AIB.
Según Benítez (2014) analizando el efecto del AIB en el número de raíces de menta (Mentha arvensis L.), donde los sustratos que recibieron el tratamiento con ácido indolbutírico presentaron la mejor media de 16,31 comparando con los que no recibieron el AIB con 11,48 de número de raíces.
Resultado similar reportado por Román (2014), para el efecto dosis de AIB en el efecto de la hormona AIB en el enraizamiento de estacas juveniles de Croton lechler no se observó diferencias estadísticas en las estaquillas que han sido tratadas con AIB al 1000, 2000 y 3000 ppm, pero numéricamente la dosis de 2000 ppm de AIB fue la que presentó en promedio el mayor número de raíces (3,73), seguida por la dosis de 1000 ppm (2,58) , luego la dosis de 3000 ppm (2,22) y finalmente la testigo obtuvo el menor valor promedio de número de raíces (0,02).
De Bona et al. (2012) en cambio determinaron que la adición de diferentes dosis AIB no generó diferencias significativas en el desarrollo de raíces adventicias en estacas de Lavandula angustifolia con respecto al tratamiento testigo.
También Solís et al. (2015), para el caso de cantidad de raíces observaron que las dosis de AIB de 1000 y 1500 ppm indujeron una mayor cantidad de raíces por estaca 8,4 y 9,24 respectivamente, pero sin diferencias significativas entre ellas que al usar dosis menores.
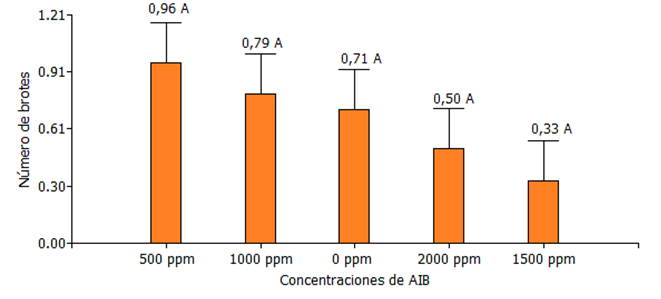
Figura 4. Medias de número de brotes de Jaguarete ka`a, evaluación realizada a los 30 días después del establecimiento. FCA-UNA, San Lorenzo. Paraguay, 2024.
En lo que respecta al número de brotes en la Figura 4, se observa que no hubo diferencia significativa entre los tratamientos, pero se puede verificar numéricamente que la aplicación de 500 ppm produjo un aumento de 0,96 brotes.
De la misma forma Quintanilla (1991) en el enraizamiento de estacas de Eucaliptus camaldulenses con tres dosis con ácido indolbutírico, en el número de estacas con brotes, el testigo mostró mayor número de brotes que los tratamientos hormonales, y estos no presentaron diferencias entre ellos.
Oyanadel (2002), al realizar el análisis del número de brotes en el efecto del AIB sobre el grado de enraizamiento en Buddleja globosa, se detectaron diferencias altamente significativas, encontrándose los valores más altos 0,8 brotes en el testigo y la concentración 125 ppm de AIB respectivamente, decayendo a medida que aumenta la concentración hormonal.
Los resultados demuestran variaciones influenciadas por la variedad y dosis de AIB. Estos efectos también pueden verse afectados por el tipo de material vegetal empleado (Huamantingo, 2016).
Conclusión
El ácido indolbutírico tiene un efecto significativo en el número de raíces a concentración de 2000 ppm, pero no hubo significancia en el porcentaje de enraizamiento y cantidad de brotes. Se puede evidenciar en este estudio que al aumentar las concentraciones de la hormona AIB aumenta el número de raíces, pero disminuye el número de brotes en Jaguarete ka'a.
Recomendación
Se recomienda continuar con el trabajo de investigación, utilizando otras concentraciones de ácido indolbutírico u otras hormonas, además ampliar el periodo de evaluación y combinar con otros factores como distintas secciones de esqueje, épocas del año, que podrían afectar las condiciones de calidad de los esquejes en su propagación.
Contribución de los autores: Conceptualización: J.V.B.N. Curación de datos: M.E.R.P., J.V.B.N.; N.J.Z.C., M.E.V.B., F.M.M.C. Análisis formal: M.E.R.P., J.V.B.N.; N.J.Z.C., M.E.V.B., F.M.M.C. Adquisición de fondos: J.V.B.N.; Investigación: M.E.R.P., J.V.B.N., N.J.Z.C., M.E.V.B., F.M.M.C. Metodología: J.V.B.N., M.E.R.P., N.J.Z.C., M.E.V.B., F.M.M.C. Administración del proyecto: J.V.B.N.; Recursos: J.V.B.N., N.J.Z.C. Software: M.E.R.P.; Supervisión: M.E.R.P., J.V.B.N., N.J.Z.C., M.E.V.B., F.M.M.C. Validación: N.J.Z.C. Visualización: J.V.B.N.; Redacción – borrador original: M.E.R.P. Redacción – revisión y edición: J.V.B.N.
Fuente de Financiamiento: Esta investigación no recibió financiamiento externo.
Disponibilidad de datos: Los datos utilizados en esta investigación podrán ser solicitados al autor de correspondencia según pertinencia.
Referencias Bibliográficas
Audesirk, T., Audesirk, G., y B. Byers, B. E. (2008) Biología: la Vida en la Tierra. 8ª ed. Pearson Educación de México. México, 1024 p.
Balaguera, H., Morales, E., Almanza, P., y Balaguera, W. (2010). El tamaño del cladodio y los niveles de auxina influyen en la propagación asexual de pitaya (Selenicereus megalanthus Haw.). Revista Colombiana de ciencias hortícolas, 4 (1), 33-42. https://doi.org/10.17584/rcch.2010v4i1.1222
Barba, F. J., Criado, M. N., Belda-Galbis, C. M., Esteve, M. J., y Rodrigo, D. (2014) Stevia rebaudiana Bertoni as a natural antioxidant/ antimicrobial for high pressure processed fruit extract: processing parameter optimization. Food Chemistry, 148, 261-267. https://doi.org/10.1016/j.foodchem.2013.10.048
Benítez, C. (2014). Enraizamiento de Menta (Mentha arvensis L.) con dos tipos de sustratos y la interacción de ácido indol butírico (AIB). (Tesis de grado, Carrera de Ingeniería Agronómica). San Lorenzo. Facultad de Ciencias Agrarias, UNA.
Boggino, C. (2001). Propagación vegetativa de typycha Kuratu (Scoparía dulces L.) por medio de estacas semileñosas. San Lorenzo. Facultad de Ciencias Agrarias, Universidad Nacional de Asunción.
Bona, C., Biasi, I., Nakashima, T., Zanette, F., y Correa, C. (2002). Carqueja: cultive esta idéia. Curitiba. SEAB-PR; UFPR. 18 p.
Cabello, M. M., y Salas Pino, P. A. (2004). Efecto del ácido-3-indol butirico en el enraizamiento de esquejes de «jaguarete ka'a» Baccharis trimera Less. DC. Revista Investigación Agraria, 6(2), 24 - 28. https://www.agr.una.py/revista/index.php/ria/article/view/145
Candia Román, H. (2008). Hierbas medicinales. Poha kaʼavo Paraguay. El país-Diario Última Hora, Asunción. https://portalguarani.com/2320_hernan_candia_roman/21888_jaguarete_ka_700a_o_carqueja__obra_de_investigacion_prof_dr_hernan_candia_roman.html#:~:text=El%20jaguaret%C3%A9%20ka%CA%BCa%20o%20carqueja,norte%20y%20centro%20de%20Argentina
Castro, D. y Álvarez, J. (2013). Micropropagación clonal de tres genotipos mortiño, Vaccinium meridionale SW., por proliferación de yemas axilares. Actualidades Biológicas, 35 (99), 145-160
De Bona, C., Masetto, M., Deschamps, C., y Biasi L. (2012). Rooting induction of different Lavandula angustifolia accessions by auxin application. Semina: Ciências Agrárias, 33 (1), 175-182. https://doi.org/10.5433/1679-0359.2012v33n1p175
Di Rienzo, J. A., Casanoves, F., Balzarini, M. G., González, L., Tablada, M., y Robledo, C. W. (2020) Software estadístico InfoStat, versión 2020. Grupo InfoStat. FCA, Universidad Nacional de Córdoba, Argentina.
Díaz, G. (2016). Evaluación de enraizadores en moringa (Moringa oleifera), con diferentes sustratos y grosores de material vegetativo; Retalhuleu. (Tesis de grado, Universidad Rafael Landívar).
Díaz Gabutti, M. S., Leporati, J., y Verdes, P. (2018). Propagación in vitro de germoplasma nativo de Hedeoma multiflora Benth. vía organogénesis. Biotecnología Vegetal, 18 (2), 105-110. https://revista.ibp.co.cu/index.php/BV/article/view/581/pdf
Dirchwolf, P., y Schroeder, M. (2015). Establecimiento de un método de propagación vegetativa para Catharanthus roseus (L.). Revista Cubana de Plantas Medicinales, 20(2), 200-211. http://scielo.sld.cu/pdf/pla/v20n2/pla05215.pdf
Garbanzo, G., Vega, E., Rodríguez J., Urbina, C., Lázaro W., Alvarado, K., Barrientos, R., Duarte, K., Mora, J., Trujillo, V., y Rojas, J. (2021). Evaluación de tamaño de cladodios y bio-estimulantes de enraizamiento para la propagación de pitahaya. Agronomía Costarricense, 45 (2), 29-40. https://dx.doi.org/10.15517/rac.v45i2.47765
Hartmann, H., y Kester, D. (2005). Propagación de plantas: principios y prácticas. México, Editorial Continental.
Hartmann, T., y Kester, E. (1996). Propagación de plantas: principios y prácticas. Editorial Continental S.A.
Huamantingo, J. (2016). Evaluación del crecimiento de plantines de dos variedades de arándano (Vaccinium corymbosum L.) en tres pisos altitudinales a condiciones de vivero en Abancay – Apurímac. (Tesis de Grado, Universidad Tecnológica de los Andes). Abancay, Perú.
Latsague, M., Sáez, P., y Hauenstein, E. (2008). Inducción de enraizamiento en estacas de Berberidopsis corallina con ácido indolbutírico. BOSQUE, 29(3), 227-230.
López, A., Burgos, A. y Cenóz, P. (2008). Incidencia de un regulador de crecimiento y del sustrato sobre la multiplicación agámica de Ocimum selloi Benth. Horticultura Argentina, 27 (62), 11-15.
López, S., Mostacero, J., López, A., Gil, A., y De la Cruz, A. (2020), Le efecto del ácido indolbutírico en la inducción de raíces de esquejes de tallo con yema de Codiaeum variegatum (Euphorbiaceae). Revista Manglar, 17(2), 177-181. https://erp.untumbes.edu.pe/revistas/index.php/manglar/article/view/164/300
Oliveira, L., Nepomuceno, C., Freitas, N., Pereira, D., Silva, G., y Lucchese, A. (2011). Vegetative propagation of Hyptis leucocephala Mart. Ex Benth. And Hyptis platanifolia Mart. Ex Benth. Revista Brasileira de Plantas Medicinais Botucatu, 13 (1), 73-78. https://doi.org/10.1590/S1516-05722011000100011
Oyanadel, R. (2002). Propagación por esquejes de tres especies medicinales Buddleja globosa Hope., Aristotelia chilensis (Mol) Stuntz. y Aloysia triphylla L’Her. mediante el uso de ácido indolbutírico (Tesis de grado, Universidad austral de Chile). http://cybertesis.uach.cl/tesis/uach/2002/fao.98p/doc/fao.98p.pdf
Paredes-Suárez, P. C., Buatista-Gálvez, A., Ortega-Ramírez, M. E., Jiménez-Vera, R., Benítez-Mandujano, M., y González-Cortés, N. (2021). Enraizamiento de mini esquejes de Stevia rebaudiana bertoni con ácido indolbutírico en hidroponía. Revista Fitotecnia Mexicana, 44 (3), 367 – 372. https://revistafitotecniamexicana.org/documentos/44-3/9a.pdf
Pin, A., González, G., Marín, G., Céspedes, G., Cretton, S., Christen, P., y Roguet, D. (2009). Plantas medicinales del jardín botánico de Asunción. Asunción. Municipalidad de Asunción, AEPY..
Quintanilla, J. R. (1991). Enraizamiento de estacas de Eucalyptus camaldulensis. Revista centro agronómico tropical de investigación y enseñanza, pp. 15 – 19. Repositorio CATIE https://repositorio.catie.ac.cr/bitstream/handle/11554/6206/A5207e.pdf?sequence=1&isAllowed=y
Rastogui, A., Siddiqui, A., Mishra, B. K., Srivastava, M., Pandey, R., Misra, P., y Shukla, S. (2013). Effect of auxin and Gibberellic acid on growth and yield components of Linseed (Linum usitatissimum L.). Crop Breeding and Applied Biotechnology, 13 (2), 136-143. Doi:10.1590/S1984-70332013000200006
Ringphawan, M., y Pauline, A. (2019). Effect of various levels of IBA and stem cutting sizes on propagation of dragon fruit (Hylocereus polyrhizus). Current Horticulture, 7(1), 64-68
Román, G. (2014). Efecto de la hormona AIB en el enraizamiento de estacas juveniles de Croton lechler Muell. Arg. (Trabajo de Grado, Facultad de Ciencias Forestales. Universidad Nacional Agraria). Repositorio Institucional de la Universidad Nacional Agraria La Molina (UNALM) https://repositorio.lamolina.edu.pe/bitstream/handle/20.500.12996/2360/K10-R758-T.pdf?sequence=1&isAllowed=y
Ruiz, H., y Mesén, F. (2010). Efecto del ácido indolbutírico y tipo de estaquilla en el enraizamiento de sacha inchi (Plukenetia volubilis L.) Agronomía Costarricense, 34 (2), 259-267. www.mag.go.cr/rev agr/index.html
Ruiz, R., Vargas, J., Cetina, V., y Villegas Monter, A. (2005). Efecto del ácido indolbutírico (AIB) y tipo de estaca en el enraizado de Gmelina arborea Roxb. Revista Fitotecnia Mexicana, 28 (4), 319-326. https://www.redalyc.org/pdf/610/61028403.pdf
Salas, P., y Laviosa, G. (1998). Multiplicación vegetativa de yerba mate por estacas terminales con hojas. Revista Investigación Agraria, 2 (1), 28-31.
Silva, S., Dos, A., Ávila, T.T., Junior, J., Loy, F., y Ávila, D. (2007). Propagação vegetativa de pinhão-manso (Jatropha curcas L.) via estaquia no rio grande do sul. In II Congresso da Rede Brasileira de Tecnologia de Biodiesel. Anais, p. 219-223
Solís, C., Jiménez, V., y Arias, J. (2015). Propagación asexual de azul de mata (Justicia tinctoria (oerst.) D. N. Gibson, Fam. Acanthaceae) por medio de estacas. Revista agronomía costarricense, 39(2), 91-104. https://www.redalyc.org/journal/436/43642603007/html/
Taiz, L., y Zeiger, E. (2006). Fisiología Vegetal. vol. 2 Castelló de la Plana. Universitat Jaume J.
Tejada, J., Oliva, M., Collazos, R., Vilca, N., y Huaman, E. (2019). Efecto del ácido indolbutírico (AIB) sobre el enraizamiento y adaptabilidad de segmentos nodales de arándano (Vaccinium corimbosum L.). Revista de Investigación de Agroproducción Sustentable, 3(3), 24. DOI:10.25127/aps.20193.498
Vera Jiménez, M. I. del, Barreto del Puerto, M., Velázquez, M., y Degen de Arrúa, R. (2009). Plantas medicinales de tres áreas silvestres protegidas y su zona de influencia en el sureste de Paraguay. Fundación Moisés Bertoni, para la Conservación de la Naturaleza. Asunción. Universidad Nacional de Asunción. https://www.researchgate.net/publication/363707859_Plantas_Medicinales_de_tres_areas_silvestres_protegidas
