Introducción
Las plantas
nombradas comúnmente como menta, son plantas herbáceas del género Mentha,
con una colección de más de 60 especies pertenecientes a la familia Lamiaceae,
se originó en la cuenca del Mediterráneo y se extendió por todo el mundo, tanto
por medios naturales como artificiales (Tucker, 2006), las especies M.
arvensis y M. piperita son las comercialmente más valiosas y más
difundidas en todo el mundo (Wei
et al., 2023). De
manera que M. arvensis, es muy utilizada y tiene una gran
demanda en las industrias cosméticas, farmacéuticas y de alimentos (Manh y
Tuyet, 2020; Kim et al., 2021; Souza et al., 2014). También es una planta
ampliamente utilizada con fines terapéuticos debido a la gran diversidad de
compuestos bioactivos aislados e identificados, principalmente en las partes
aéreas de las plantas (Silva et al., 2022). Sus aceites esenciales son muy
valiosos (Mystkowska et al., 2016), además, es muy apreciada por su aroma,
siendo el componente principal del mismo, el mentol, en especial la especie M.
arvensis, presentando por estas características su importancia en
diferentes industrias (Masumoto y Ito, 2023). Además, para extraer los
compuestos con propiedades medicinales de la menta, en especial para el consumo
tradicional, éstas pueden pasar por diferentes procesos como: infusión,
maceración, decocción para el consumo popular (Soares et al., 2015).
En el Paraguay, la especie,
M. arvensis fue introducida entre los años 1970 a 1980, por los colonos
brasileños, que la plantaban como "cultivo de cabecera" en suelos
recién habilitados ('rozado') que luego de cuatro a cinco años de plantación,
eran desplazados por cultivos de soja y maíz (Resquín et al., 2011), en la
actualidad el cultivo de la Mentha spp. (M. arvensis; M.
piperita; M spicata) se encuentran diseminadas en toda la región
Oriental, principalmente en pequeñas fincas, la producción es muy valorada como
rubro alternativo, relevante dentro de la diversidad agrícola de renta, las
principales industrias yerbateras del país utilizan la materia prima para la
elaboración de la yerba mate compuesta, ya que esta hierba es uno de los
principales ingredientes de este producto, y su consumo es muy aceptado en el
mercado local (Camps, 2008; Resquín et al., 2011; Armadans et al., 2020).
También ha sido muy empleada tradicionalmente, desde su introducción, como una
planta medicinal, mediante la preparación de infusiones para su consumo (Pin et
al., 2009).
Para la propagación de esta
especie, tradicionalmente se utilizan las estacas como material vegetativo,
este método tiene desventajas como la lentitud en la multiplicación y el hecho
de que, al igual que en otras especies que se multiplican de forma vegetativa,
se emplea como material de propagación una parte cosechable de la planta. Sin
embargo, una técnica, denominada cultivo de tejidos ha demostrado su utilidad
en la solución de ambos problemas en numerosas especies, entre ellas las mentas
(Godoy et al., 2005).
El “cultivo de tejidos” ó
“cultivo in vitro”, es una herramienta biotecnológica que se basa en la
micropropagación de plantas bajo condiciones controladas (luz, temperatura,
humedad, entre otros factores), además para el éxito de esta técnica, se
requieren condiciones de asepsia de los explantes, para lo cual se eliminan los
microorganismos contaminantes, utilizando diferentes métodos de desinfección,
que no dañen al explante y permitan la multiplicación a gran escala (Castillo,
2004). La micropropagación comprende diferentes etapas, siendo la etapa 0, la
selección y tratamiento de la planta madre, la etapa 1, involucra la
desinfección y el establecimiento, la etapa 2, la regeneración, la etapa 3, en
el cual se da el desarrollo de la plántula, mediante el crecimiento radicular y
aéreo, y la etapa 4, en el cual la vitroplanta completó su crecimiento, y se
procede a la aclimatación, en donde se prepara a las plantas con la finalidad de
hacer frente condiciones ambientales, y es fundamental ajustar todas estas
etapas para tener éxito con esta técnica, para una propagación a gran escala
(Loberant y Altman, 2010).
La micropropagación in
vitro de plantas presenta algunas ventajas ante la propagación convencional
como el espacio reducido que se requiere, los factores que influencian la
regeneración vegetativa como los nutrientes, hormonas, luz y temperatura pueden
ser modificados según los requerimientos de cada especie, así como la obtención
de clones, la producción puede durar todo el año (George, 2008). En los últimos
tiempos se ha empleado la micropropagación para cultivar de forma masiva
diferentes especies de plantas (Sharry, 2015), y tiene importantes papeles en
la producción de plantas medicinales con respecto a la independencia de la
variación estacional, producción en masa, identificación y producción de clones
con las características y condiciones deseadas y la manipulación del
microambiente para una mayor producción del metabolito de interés, de gran
escala a corto plazo (Beduhn et al., 2016).
Como ya se mencionó, en el
mercado paraguayo existe una gran demanda de las especies de Mentha, por
ser utilizadas como aditivos en la yerba mate compuesta debido a su sabor y
aroma (Armadans et al., 2020), por lo que existen periodos de escases de esta
hierba. El desarrollo y uso de esta herramienta para la multiplicación de M.
arvensis podría ser de gran utilidad para impulsar avances importantes en
la industria nacional. Sin embargo, un obstáculo durante la propagación de
especies de menta, sobre todo en la etapa de establecimiento in vitro,
es la aparición de abundantes contaminaciones causadas por hongos y bacterias,
posiblemente por su hábito de crecimiento y escaso porte (Héctor et al., 2005).
Por todo lo expuesto, y para mejorar
las perspectivas de la producción de esta especie, se ha planteado como
objetivo del trabajo, el ajuste del protocolo de desinfección para el
establecimiento in vitro y posterior evaluación de sustratos más aptos para
la aclimatación en casa de vegetación de la menta (Mentha arvensis L.).
Materiales
y Métodos
El
trabajo de investigación fue realizado en el Laboratorio de Biotecnología, del
Centro Multidisciplinario de Investigaciones Tecnológicas (CEMIT), de la Universidad
Nacional de Asunción (UNA), entre los meses comprendidos de enero y marzo del
año 2023 y constó de dos etapas, 1: Protocolo de desinfección y establecimiento
in vitro; y, 2: Protocolo de aclimatación de las vitroplantas en casa de
vegetación.
Obtención del material
vegetal
Para
la obtención de los segmentos nodales, fue seleccionada una planta madre de un stock
de plantas de Mentha arvensis provistas por la empresa Industria
Yerbatera Santa Margarita S.A. las cuales fueron trasladadas hasta las instalaciones
del CEMIT, y se mantuvieron en la casa de vegetación. Las plantas,
primeramente, pasaron por un periodo de cuarentena de 21 días, para superar el
estrés producido por el traslado de la zona de origen (San Juan, Dpto. de
Misiones) hasta el Campus Universitario de la Ciudad de San Lorenzo (Dpto.
Central), además de descartar la posible aparición de enfermedades. Una vez
pasado este periodo, fue seleccionada la planta madre, según criterios de:
buenas condiciones de vigor, sanidad y cantidad de ramas. Para la obtención de
los explantes (segmentos nodales con un nudo), fueron cortadas las varas, con
una longitud de 20 cm, midiendo desde el ápice de dicha rama. La población
total estuvo constituida por 80 segmentos nodales, divididos en 20 segmentos nodales
por tratamiento, utilizando 4 repeticiones cada uno.
Desinfección y establecimiento del
cultivo in vitro
Las varas colectadas fueron llevadas al
laboratorio, inmersas en una solución antioxidante (100 mg/L de ácido ascórbico
LASCA®, 50 mg/L ácido cítrico LASCA®, y 100 mg/L de
polivinilpirrolidona Sigma-Aldrich®). Para la obtención de los
explantes, las varas fueron cortadas en secciones de 2 cm aproximadamente, que
contenían un nudo con yemas axilares, además les fueron retiradas las hojas.
Posteriormente se realizó un lavado de con agua corriente e inmersión en una
solución de 1L de agua y 6 gotas de Tween 20 con agitación leve durante 5 minutos. Posteriormente
se procedió a la desinfección según los diferentes tratamientos
descritos en la Tabla 1.
Tabla 1. Diferentes tratamientos para la
desinfección de segmentos nodales de M. arvensis.
|
Tratamientos
|
NaClO
|
Tiempo
de exposición (minutos)
|
|
T1
|
1
%
|
10
|
|
T2
|
1,5
%
|
10
|
|
T3
|
1
%
|
15
|
|
T4
|
1,5
%
|
15
|
Para el porcentaje de sobrevivencia se
puede observar que no hubo diferencia significativa, arrojando valores de 91,6
a 100 % de sobrevivencia en todos los tratamientos. Por otro lado, evaluando el
desarrollo de la planta (altura y números de brotes) si se pudo observar que
hay diferencias significativas, siendo los mejores los tratamientos T2 y
T3, que utilizaron sustrato comercial y sustrato comercial + perlita
1/1 respectivamente.
Discusión
La
regeneración en condiciones in vitro, tuvo un éxito del 80 % en el mejor
tratamiento, este valor dista en un poco más del 20 %, según los reportados por
Faisal et al. (2014), que, evaluando la multiplicación in vitro de M.
arvensis, tuvo un éxito de regeneración en términos de porcentaje de 92 %.
Según Gomes et al. (2015) las
especies del género Mentha presentan diferentes potenciales de
propagación in vitro, siendo M. piperita, M. longiflora y M.
arvensis, las de mayor potencial de propagación y en general, la mayor tasa
de multiplicación para las especies de Mentha se obtiene a partir del
3er subcultivo. Los mismos autores mencionan que se estima que, el potencial de
producción de estas especies, en condiciones in vitro, varía dependiendo
de cada especie.
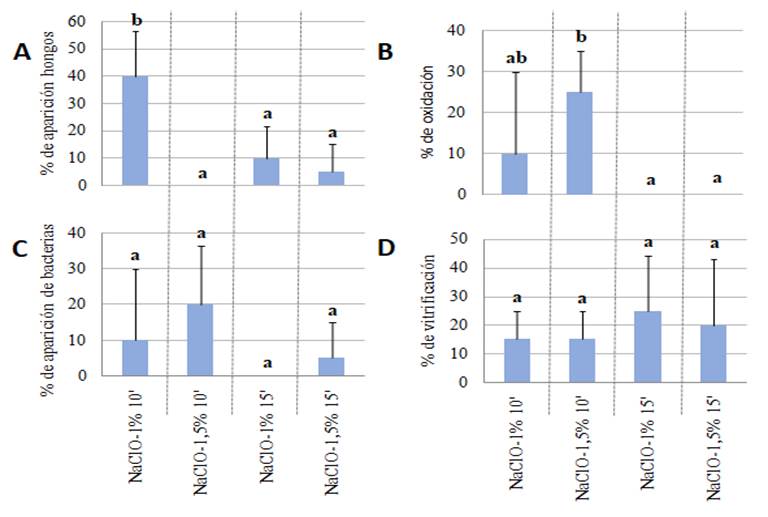
Contaminación por
bacterias y hongos
Según Héctor et al. (2005)
un obstáculo durante la propagación de especies de menta, sobre todo en la
etapa de establecimiento in vitro, es la aparición de abundantes
contaminaciones causadas por hongos y bacterias, posiblemente por su hábito de
crecimiento y escaso porte de la especie. Como ya se vio, en el caso de la
contaminación por bacterias, en el presente trabajo, los tratamientos con mayor
aparición fueron T1, y T2, con una concentración de NaClO
1 % y 1,5 % respectivamente por 10 minutos, en este ensayo, más que la
concentración del agente desinfectante, tuvo efecto el tiempo de exposición de
los explantes, ya que los que tuvieron un mayor tiempo de inmersión tuvieron
nulo o menor aparición de bacterias, estos resultados tuvieron mayor éxito que
lo reportados por Héctor et al. (2005), que mencionan, en sus resultados de
investigación, que, en su método de desinfección de M. arvensis mediante
la utilización de alcohol 70 % por 1 minuto y solución de NaClO comercial al 5,5
% diluido al 15 % por un periodo de 10 minutos, la contaminación por bacteria
fue del 95 %. El método empleado en el presente trabajo resultó ser más
efectivo contra bacterias. Borges et al., 2009, evaluando distintas
concentraciones de hipoclorito de sodio (1,5; 2 y 2,5 %), en diferentes tiempos
de inmersión para
el establecimiento in vitro de Discorea alata, encontraron que,
el mejor tratamiento fue en la concentración de NaClO al 1,5 % por 30 minutos
de inmersión, que tuvo un efecto del 90 % para la desinfección.
Así mismo, en la presente
investigación, la mayor parte de los microorganismos contaminantes fueron
hongos filamentosos y bacterias. Folgueras et al. (2001) y Rodríguez et al.
(2008), mencionan que los contaminantes más comunes durante en establecimiento in
vitro de explantes, extraídos de plantas adultas corresponden a hongos
filamentosos y bacterias.
Oxidación y
Vitrificación
Sharry (2015) menciona que
el carbón activado puede absorber compuestos que promueven la oxidación de las
plantas, como los compuestos fenólicos y taninos, además de algunos ácidos como
el ácido benzoico, ácido caprílico y ácido pelargonio. Fridborg et al. (1978)
mencionan que estos compuestos influyen en el desarrollo correcto de las
plantas cultivadas in vitro. Cabe resaltar que en la presente
investigación se utilizaron 2 g/L de carbón activado Biopak® en
todos los tratamientos, para anular o disminuir la oxidación de las
vitroplantas.
A pesar de la utilización
del carbón activado y antioxidantes, previo a la desinfección, se observaron
plántulas con síntomas de oxidación. A la vez se observó el efecto de
vitrificación, según Perugorría Larroque (2012) para evitar los efectos de
hiperhidricidad o vitrificación es necesario emplear en el medio de cultivo
compuestos como el floroglucinol, ácido cítrico y el ácido ascórbico los cuales
ayudan a que la vitrificación sea menor.
Aclimatación en casa de
vegetación
En cuanto a la sobrevivencia
de las plantas de menta, en la casa de vegetación, se observó que no existen
diferencias significativas en cuanto al sustrato utilizado, donde el T1
y T2 presentan un promedio de supervivencia aproximado del 92 %, y
el T3 presenta el 100 % de plantas aclimatadas. Valores similares
fueron registrados por Vacca-Molina et al. (2015), los cuales propagando
plántulas de menta obtuvieron una tasa de supervivencia del 100 % utilizando
como sustrato humus de lombriz (orgánico y muy rico en nutrientes) y una
combinación de perlita:arena:humus en proporción (1:1:1).
En el parámetro altura de
plantas, se observó que existe una diferencia significativa en T1
respecto al T2 y T3. Presentando aproximadamente una
diferencia de 10 cm en promedio. Esto pudo deberse al sustrato utilizado,
debido a que el T1 (perlita) no proporciona un soporte ni retención
de agua, esto no permite que la planta pueda desarrollarse en su máxima
plenitud. Espinosa-Reyes et al. (2019) mencionan que el tipo de sustrato
utilizado tiene un efecto significativo en el crecimiento de las plantas,
sugiriendo utilizar estiércol vacuno en combinación con suelo y zeolita debido
a que esto se asocia con un mejor desarrollo de las plantas.
En cuanto al número de brotes obtenidos
por planta, también se observa que existe una diferencia significativa en el
tratamiento 1, presentando en promedio 1 brote por planta. Esto puede asociarse
nuevamente al sustrato utilizado. Sin embargo, las plantas que contienen el
sustrato comercial responden de manera positiva en cuanto a brotación, lo que
afirma que el sustrato perlita en proporción 100 % no es favorable para
realizar la aclimatación de plántulas de menta obtenidas in vitro.
Conclusión
En el presente trabajo se
logró el establecimiento in vitro de segmentos nodales de M. arvensis,
obteniendo los mejores resultados para contar con plántulas asépticas en los
tratamientos de desinfección 3 y 4, con una concentración de NaClO al 1 % y 1,5
% por 15 minutos de inmersión.
En la etapa de aclimatación
se obtuvieron muy buenos resultados en líneas generales, pero el mejor tipo de
sustrato fue el sustrato comercial Carolina® + perlitas dando un 100
% de plantas regeneradas con buen rebrote y follaje. Por otra parte, no se
recomienda el empleo de perlita al 100 % como sustrato, ya que el crecimiento
se ve disminuido.
La micropropagación de M. arvensis
resulta bastante prometedora como alternativa de producción agrícola en
Paraguay para la multiplicación masiva del cultivo.
Agradecimientos
A la empresa Santa Margarita y al Ing.
Agr. Celso Cubilla por la provisión de los materiales de M. arvensis
para los diferentes ensayos.
Fuente
de Financiamiento
Sin financiamiento externo.
Contribución de los autores
Concepción del estudio: M.E.V.B., F.M.M.C., J.V.B.N. Diseño del experimento: M.E.V.B., F.M.M.C., J.V.B.N. Ejecución del experimento: M.E.V.B., F.M.M.C., J.V.B.N. Verificación del experimento: M.E.V.B., F.M.M.C., J.V.B.N. Análisis/interpretación de datos: M.E.V.B., F.M.M.C., J.V.B.N., A.S.O.,
H.D.N., C.C.M. Análisis
estadísticos: M.E.V.B.,
F.M.M.C., J.V.B.N., A.S.O., H.D.N., C.C.M. Preparación del manuscrito: M.E.V.B., F.M.M.C., A.S.O., H.D.N.,
C.C.M. J.V.B.N., I.C.G. Edición
y revisión del manuscrito:
M.E.V.B., F.M.M.C., J.V.B.N., A.S.O., H.D.N., C.C.M., I.C.G. Aprobación de la versión final del
manuscrito: M.E.V.B.,
F.M.M.C., J.V.B.N., A.S.O., H.D.N., C.C.M., I.C.G.
Referencias bibliográficas
Armadans,
C., Ligarreto-Moreno, G. A., De Lourdes Torres, M., & Vásquez-Guzmán, J. A.
(2020). Genetic
variability of Mentha species used for the elaboration of yerba mate (Ilex
paraguariensis St. Hil.) blends in Paraguay. Acta Agronómica, 69(1), 61-68.
Beduhn, K. A., Kulkarni,
M. G., & Sathyanarayana, B. K. (2016). Plant tissue culture: applications and
limitations. In. Springer,
22(1), 45-52.
Borges, M., Estrada, E.,
Pérez, I., & Meneses, S. (2009). Uso de distintos tratamientos de desinfección en el cultivo
in vitro de Dioscoreaalata L. clon caraqueño. Revista
Colombiana de Biotecnología,11 (2), 127-135.
Castillo, A.
(2004). Propagación de plantas por cultivo in vitro: una biotecnología que
nos acompaña hace mucho tiempo. INIA, Uruguay.
Camps, E.. (2008).
Elaboración del estudio de la situación de la recolección, producción y
comercialización de las plantas medicinales y aromáticas del Paraguay. Programa
regional de apoyo a la red de desarrollo de Fitoterápicos del MERCOSUR. MAG,
UNOPS, FIDA, PLAMSUR. Informe Final de Consultorio. Fundación José Cardijn.
Espinosa-Reyes,
Á., Silva-Pupo, J. J., Bahi-Arevich, M., y Romero-Cabrera, D. (2019).
Influencia del tamaño de las plantas in vitro y tipo de sustrato en la
aclimatación de Morus alba L. Pastos y Forrajes, 42(1), 23-29.
Faisal, M.,
Alatar, A. A., Hegazy, A. K., Alharbi, S. A., El-Sheikh, M. & Okla, M.
K.(2014). Thidiazuron
induced in vitro multiplication of Mentha arvensis and evaluation
of genetic stability by flow cytometry and molecular markers. Industrial Crops and Products, 62, 100-106.
Folgueras, M.,
Herrera, L. y Carrazana, D. (2001). La contaminación microbiana en la
micropropagación in vitro de las raíces y tubérculos tropicales. En: Libro
de reportes cortos. Taller Internacional BioVeg. Cuba. Ciego de Avila. 193-185.
Fridborg, G.,
Pedersen, M., Landström, L. E., & Eriksson, T. (1978). The effect of
activated charcoal on tissue cultures: adsorption of metabolites inhibiting
morphogenesis. Physiologia Plantarum, 43(2), 104-106.
George, E. F.,
Hall, M. A., & Klerk, G. J. D. (2008). Micropropagation: uses and
methods. Plant Propagation by Tissue Culture. 3rd. ed. Volume 1.
The Background, 29-64.
Godoy, H.,
Pacheco, P., Sánchez-Olate, M., y Zúñiga, G. (2005). Micropropagación de plantas: una
herramienta para la propagación masiva de menta (Mentha x piperita
L. y Menthaspicata L.). Agricultura Técnica, 65(2), 137-147.
Gomes, H. T.,
Bartos, P. M. C., Martins, A. E., Omari, S., Oliveira, D., &
Scherwinski-Pereira, J. E. (2015). Assessment of mint (Mentha spp.) species for
large-scale production of plantlets by micropropagation. Acta Scientiarum, 37(4), 405-410.
Héctor, E.,
Barrón, M. L., Godoy, L., Díaz, B., Hernández, M. M. y Torres, A. (2005). Un
método para la desinfección y el establecimiento in vitro de la menta
japonesa (Mentha arvensis L.). Cultivos Tropicales, 26(1), 69-71.
InfoStat (2008). InfoStat,
versión 2008. Manual del Usuario. Grupo InfoStat, FCA, Universidad Nacional
de Córdoba. Editorial
Brujas Argentina.
Kim, S.-Y.,
Han, S.-D., Kim, M., Mony, TJ, Lee, E.-S., Kim, K.-M., Choi, S.-H., Hong, SH,
Choi, JW & Park, SJ (2021).Mentha arvensis essential oil exerts
anti-inflammatory in LPS-stimulated inflammatory responses via inhibition of
ERK/NF-κB signaling pathway and
anti-atopic dermatitis-like effects in 2,4-dinitrochlorobezene-induced BALB/c
Mice. Antioxidantes, 10(12), 1941.
https://doi.org/10.3390/antiox10121941
Loberant, B.
& Altman, A. (2010). Micropropagation of plants. Encyclopedia of
industrial biotechnology: Bioprocess, bioseparation, and cell technology. New York .Wiley, 3499-3515.
Manh, H. D., y Tuyet, O.T
(2020).Actividad larvicida y repelente del aceite esencial de Mentha
arvensis L. contra Aedes aegypti. Insectos,11(3), 198.
https://doi.org/10.3390/insects11030198
Masumoto, N.y Ito, M.
(2023). Identificación genética de las especies de plantas originales de
MenthaHerb enumeradas en la Farmacopea Japonesa y análisis de su composición de
aceites esenciales. Diario de Medicinas Naturales , 77 (3),
489–495. https://doi.org/10.1007/s11418-023-01690-1
Murashige, T.
& Skoog, F. (1962). Revised
medium for rapid growth and bioassay with tobacco tissue cultures. Physiol
Plant, 15(3), 473 – 497.
Mystkowska,
I., Zarzecka, K., Baranowska, A., & Gugala, M. (2016). Miętapieprzowa (Mentha
piperita L.)-roślinazielarska o
różnorodnychwłaściwościachbiologicznychileczniczych. Herbalism,2 (1), 1-10.
Perugorría
Larroque, M. (2012). Desarrollo
de una técnica para micropropagación de especies leñosas en biorreactores.
(Tesis de maestría no publicada). Uruguay. Universidad de la República. Facultad de Ciencias.
Pin, A.,
González, G., Marin, G., Céspedes, G., Cretton, S., Christen, P., y Roguet, D.
(2009). Plantasmedicinales del Jardín Botánico de Asunción. Asociación
Etnobotánica Paraguaya.
Resquín, G.,
De Arrúa, R., De Rojas, G. y Macchi, L. (2011). Las especies de Mentha
L. cultivadas en Paraguay. Rojasiana, 10(1), 77-91.
Rodriguez, M.,
Matehus, J., Gersti A. y Santana, M. A. (2008). Identificación de Agente causal
de bacteriosis en ñame (Discoreaalata L.). Interciencia, 33(7),
1-11.
Sharry, S.
(2015). Plantas de probeta. La Plata, Argentina. Editorial de la
Universidad Nacional de La Plata (EDULP).
Silva, E. C.
V. da., Silva, A. de S. ., Silva, D. F. ., Ferreira, M. D. L. ., Oliveira
Filho, A. A. de ., y Sousa, A. P. de. (2022). Análisis químico y
antimicrobiano de plantas medicinales presentes en Horto das Faculdades Nova
Esperança. Archivos Científicos Electrónicos , 15 (3). https://doi.org/10.36560/15320221518
Soares, M., Da Fonseca,
E., Macedo, C. y Dolabela, O. (2015). Fitoquímica dos chás: Beneficios e
propriedades da Mentha piperita. (Resumen). IX Fórum de Ensino,
Pesquisa, Extensão e Gestão, 2p.
Souza, M. A.
A., Lemos, M. J., Brito, D. M. C., Fernandes, MS, Castro, R. N. y Souza, S. R.
(2014). Producción y
calidad de aceite esencial de menta mentolada y actividad antifúngica y
antigerminativa.Revista estadounidense de ciencias de las plantas,05(21),
3311–3318. https://doi.org/10.4236/ajps.2014.521346
Tucker, A. O.
(2006). Mentha: Economic uses. In B. M. Lawrence (Ed.), Mint: The
Genus Mentha (1st ed., pp. 519-528). Boca Raton, FL. CRC Press.
Vacca-Molina,
M., Velásques, J. D., Bonomo, M. L. C., y Avilés, Z. J. (2015). Menta (Mentha
arvensis L.) micro y macropropagación. Revista Bio Ciencias, 3(3), 208-219.
Wei, H., Kong,
S., Jayaraman, V., Selvaraj, D., Soundararajan, P., & Manivannan, A.
(2023). Mentha arvensis and Mentha × piperita-Vital Herbs
with Myriads of Pharmaceutical Benefits. Horticulturae, 9, 224. doi:
10.3390/horticulturae9050224

![]() , Universidad Nacional de
Asunción. Facultad de Ciencias Químicas (UNA).
, Universidad Nacional de
Asunción. Facultad de Ciencias Químicas (UNA).![]()
![]() ,
Fernando Mathías Morínigo Céspedes 1
,
Fernando Mathías Morínigo Céspedes 1![]() ,
Juan Venancio Benítez Núñez1*
,
Juan Venancio Benítez Núñez1*![]() , Antonio
Samudio Oggero1
, Antonio
Samudio Oggero1![]() , Héctor
David Nakayama1
, Héctor
David Nakayama1![]() ,
Cinthia Cazal Martínez1
,
Cinthia Cazal Martínez1 ![]() ,
Isaura Cantero García1
,
Isaura Cantero García1![]()