
 10.57201/ieuna2323340
10.57201/ieuna2323340
Sección: Artículos Originales
*Autor correspondiente:
gloresqx@agr.una.py
Editor de área:
Andrea Arrúa , Universidad Nacional
de Asunción.
, Universidad Nacional
de Asunción.
Editor invitado:
Guillermo Enciso , Centro de Desarrollo e Innovación Tecnológica (CEDIT)
, Centro de Desarrollo e Innovación Tecnológica (CEDIT)
Recibido:
25 de abril de 2023
Aceptado:
06 de julio de 2023
Recibido en versión modificada:
6 de julio de 2023
Este
es un artículo publicado en acceso abierto bajo una Licencia Creative Commons “CC BY 4.0”. 
Declaración de conflicto: Los
autores declaran no tener conflicto de intereses.
e-ISSN
2709 - 0817
Como citar: Resquín-Romero, G. A.,
Sarubbi-Orue, H. J., Ruiz-Samudio, F. P., Chamorro-Díaz, S. M., Vera de Ortiz,
M., Golan, K. y Garrido-Jurado, I. (2023). Identificación de hongos entomopatogénicos de Atta sexdens en
un sistema silvopastoril. Revista investigaciones y estudios - UNA, 14(2), 15-25.
Identificación de hongos entomopatogénicos de Atta sexdens en
un sistema silvopastoril
Identification of entomo-pathogenic fungi of Atta sexdens in
a silvopastoral system
Gloria Arminda Resquín-Romero1 *, Humberto
Sarubbi-Orue1
*, Humberto
Sarubbi-Orue1 , Fanni Petrona Ruiz-Samudio1
, Fanni Petrona Ruiz-Samudio1 , Sergio Manuel Chamorro-Diaz1
, Sergio Manuel Chamorro-Diaz1 , Mirtha Vera de Ortiz2
, Mirtha Vera de Ortiz2 , Katarzyna Golan3
, Katarzyna Golan3 , Inmaculada Garrido-Jurado4
, Inmaculada Garrido-Jurado4
1Universidad
Nacional de Asunción. Facultad de Ciencias Agrarias. Docente Investigador del
Área Protección Vegetal. San Lorenzo, Paraguay.
2Universidad
Nacional de Asunción. Facultad de Ciencias Agrarias. Carrera de Ingeniería
Forestal. San Lorenzo, Paraguay.
3Universidad
de Life Sciences en Lublin. Departamento de Protección Vegetal, Leszczyńskiego.
Lublin, Polania
4Universidad
de Córdoba Departamento de Agronomía, ETSIAM. Campus
de Rabanales. Córdoba, España.
Resumen. Las hormigas cortadoras Ysaú (Atta sexdens) son
insectos sociales compuestas por una reina, soldados, obreras, jardineras y
zánganos, formando un nido bien organizado y de difícil manejo y/o control. En
Paraguay, en la última década, se ha convertido en una plaga invasora
importante tanto para los cultivos forestales como agrícolas. El objetivo de la
presente investigación fue la de identificar los hongos entomopatógenos (HE) en
la zona de influencia de nidos, localizados en parcelas silvopastoril comercial
de Urochloa brizantha MG-5 y Eucalyptus sp. La metodología para
aislar HE fue el uso insectos trampas o cebos a base de hormigas reinas,
colectadas e instalada en época de vuelo nupcial de los nidos de hormigas. Se
utilizaron muestras de suelo de las parcelas silvopastoril y raíces de
gramíneas (U. brizantha). También se aislaron de insectos muertos
colectados. Los datos generados sobre la incidencia de insectos micosados se
sometieron a análisis de varianza y las medias se sometieron a la prueba de
Tukey. La comparación de las poblaciones de hormigas cortadoras de hojas se
realizó mediante la prueba no paramétrica de Kruskal-Wallis para muestras
independientes, cuyos resultados mostraron que no hubo diferencias
significativas entre nidos para la variable hormigas micosados por hongos
(H=2,463; p>0,05) y para la variable, muertos por otras causas (H=3,806;
p>0,05). Los hongos entomopatógenos identificados fueron Beauveria
bassiana y Metarhizium sp. aisladas de hormigas cortadoras de
micorrizas obtenidas del área de influencia de nidos en un sistema silvopastoril.
Palabras clave: Beauveria, biocontrol, insectos trampa, Metarhizium,
Ysaú.
Abstract. Ysaú leaf cutter
ants (Atta sexdens) are social insects made up of a queen, soldiers, workers, gardeners and drones, forming a
well-organized nest that is difficult to manage and/or control. In Paraguay, in
the last decade, it has become an important invasive pest for both forestry and
agricultural crops. The objective of this research was to identify
entomopathogenic fungi (HE) in the area of influence of nests, located in
commercial silvopastoral plots of Urochloa brizantha MG-5 and Eucalyptus
sp. The methodology to isolate HE was the use of insect traps or baits based on
queen ants, collected and installed during the nuptial flight season of the ant
nests. Soil samples from the silvopastoral plots and grass roots (U.
brizantha) were used. They were also isolated from collected dead insects.
The data generated on the incidence of fungal insects were subjected to
analysis of variance and the means were subjected to Tukey's test. The
comparison of the populations of leaf-cutter ants was carried out using the
non-parametric Kruskal-Wallis test for independent samples, whose results
showed that there were no significant differences between nests for the fungal
ants variable (H=2.463; p>0 .05) and for the variable, deceased from other
causes (H=3.806; p>0.05). The entomopathogenic fungi identified were Beauveria
bassiana and Metarhizium sp. isolated from mycorrhizal cutter ants
obtained from the area of influence of nests in a silvopastoral system.
Keywords: Beauveria,
biocontrol, insect traps, Metarhizium, Ysaú.
Introducción
Los hongos entomopatógenos (HE) se consideran componentes
importantes de un manejo integrado de plagas, en particular para un sistema
silvopastoril, sea esto como biopesticidas o como microorganismos naturales
conservados en el medio ambiente (Quesada-Moraga et al., 2007). Sin embargo,
hay poca información como potencial supresor natural de insectos y sus posibles
efectos sobre los insectos bajo un manejo de la silvicultura. Los cambios en
los paisajes naturales, debido a la intensificación agrícola, han causado una
pérdida considerable de la biodiversidad y, por consiguiente, diezmar los
servicios de un ecosistema. Sin embargo, la adopción de prácticas más amigables
como el sistema silvopastoril puede fomentar condiciones abióticas y bióticas
que conserven la biodiversidad y, en consecuencia, pueden restablecer la
provisión de servicios naturales a los ecosistemas.
Existen más de
700 especies de entomopatógenas derivadas de la división de Ascomycota y
Entomophthoromycota (Hibbett et al., 2007; Humber, 2012; Gryganskyi et al., 2013)
tienen el potencial de controlar un rango de insectos plaga con su acción de
contacto única; constituyen un grupo heterogéneo desde el punto de vista
sistemático y también presentan diferencias en cuanto a su biología, actúan por
la vía tegumentaria y su virulencia frente a insectos, les convierte en un
importante factor de regulación natural de sus poblaciones (Quesada-Moraga et
al., 2007).
El objetivo
general del presente trabajo fue identificar HE presentes en la zona de
influencia de Atta sexdens (L., 1758) en un sistema silvopastoril (Urochloa
brizantha MG-5 y Eucalyptus spp.); y cuyos objetivos específicos
fueron: a) Colectar del área de estudio muestras de artrópodos muertos con
crecimiento fúngico o por otras causas; b) Inspeccionar fuentes de los
servicios naturales de un ecosistema, en suelos y área de la rizosfera de la
planta, con el uso de la técnica de insecto trampa c) Identificar con el
análisis molecular los controladores biológicos representativos obtenidos
durante la inspección de campo. (2023)
Materiales
y Métodos
Se colectaron
muestras de suelos, también se colectaron suelos
adheridos a raíces de las plantas así también insectos muertos colonizados y
no colonizados, de una parcela con sistema silvopastoril (Urochloa brizantha
MG-5 y Eucaliptus sp.), de la localidad de Santa Rosa del Aguary
(S23°43’39’’ W56°27’17’’), Departamento de San Pedro, Paraguay, en dos
oportunidades, noviembre y diciembre de 2019, utilizando el área de influencia
de 20 nidos de hormigas cortadoras de hojas (Atta sexdens, Hymenoptera:
Formicedae), de los cuales 10 nidos ubicados en áreas tratadas frecuentemente
con productos químicos (Fipronil) y 10 nidos donde se dejó de utilizar
tratamientos químicos por un año. Estos estaban localizados en un área de aproximadamente
5.000 m2 de manejo silvopastoril combinando U. brizantha MG-5
con Eucaliptus sp. (distante 2m x 5m entre planta e hilera). En total,
se utilizaron 100 puntos de muestreo. Cada punto de muestreo comprende un área
de 0,25 m2 con un intervalo de 2 m y, cada nido con un área de 8 a
10 m ancho y 15 a 20 m de largo. La distancia promedio de muestreo entre
nidos fue de 40 a 50 m, localizada al azar (Figura 1).
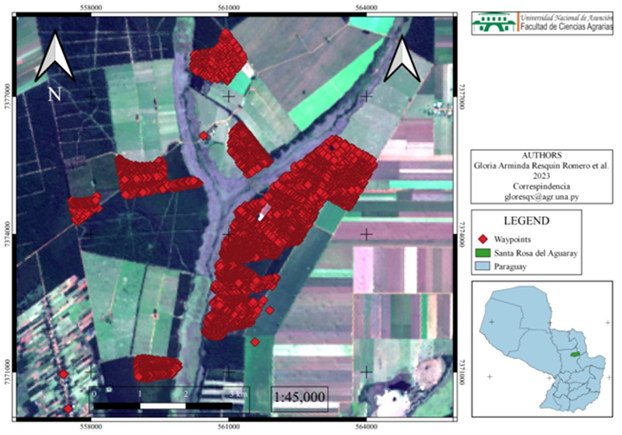
Figura 1. Geolocalización de nidos de hormigas cortadoras de hojas (Atta
sexdens) e incidencia real en áreas rurales, parcelas silvopastoriles
comerciales (Urochloa brizantha cv. MG-5 y Eucaliptus sp.)
La recolección de suelo se realizó en plena estación húmeda, a una
profundidad de 0 a 10 cm, utilizando una barrena de metal para extraer suelos.
También se extrajo raíces de plantas predominantes encontradas en cada punto de
muestreo, se usó el suelo que se desprendió de las raíces para aislar los
hongos (Figura 2 y 3).

Figura 2. A-B-C. Formación de nidos de hormigas cortadoras registradas bajo
un sistema silvopastoril (Urochloa brizantha MG-5 y Eucaliptus
sp.). Colecta de muestras: D. Suelos, E. Raíces de poáceas, E. Insectos.
Localidad: Santa Rosa del Aguaray, Dpto. San Pedro, Paraguay., año 2019.
Cada muestra de
suelo fue dividida en tres partes y distribuidas en bolsas de plásticos
transparente de 200 ml. Una parte del suelo (200 g) fueron utilizadas para
la detección de HE y otra se guardaron como material de reposición, en caso de
pérdida de material. Todas estas muestras fueron conservadas a temperatura
4°C. No se utilizó control alguno en cuanto a sustrato suelo y raíces del área
de la rizosfera se refiere.

Figura 3. A-B-C-D-E-F. Macromorfología de A. sexdens micosados
colectados del área de influencia de nidos de hormigas cortadoras. G-H-I.
Utilización de la técnica de insectos trampa (reinas aladas) como cebos para
captura de hongos entomopatógenos. J-L. Obrera micosada por Beauveria
bassiana en condiciones de cámara húmeda. K-M. Reinas aladas micosadas por Metarhizium
sp. obtenida con uso de la técnica de insectos trampa en suelo y del área de la
rizosfera de poáceas.
También se
colectó insectos muertos colonizados y no colonizados in situ,
particularmente poblaciones de hormigas; también otras poblaciones de insectos
como cercopideos (Mahanarva fimbriolata) (Figura 4). Todas estas
muestras fueron etiquetadas de acuerdo con el origen y transportados en una
conservadora al laboratorio del Área de Protección Vegetal (FCA-UNA).

Figura 4. Macromorfología de otros
insectos colectados del área de influencia de nidos de hormigas cortadoras. A.
Adultos de Mahanarva fimbriolata. B-C-D. M. fimbriolata micosados
por Metarhizium sp. E-F. Nifas de M. fimbriolata micosados por B.
bassiana. G. Estado ninfal.
Para el
aislamiento de HE de suelos y del área de la rizosfera de pasturas se utilizó
la técnica de insectos trampa (Zimmermman, 1986), a base de hormigas reinas de Atta
sexdens. Estas hormigas reinas fueron capturadas y colectadas al
momento cuando se disponían a abandonar el nido materno para copular con los
zánganos, en el mes de diciembre de 2019. Para aislar el HE de insectos
colonizadas y no colonizadas de muestras de suelo y rizosfera obtenidas del
campo, se han adoptado dos métodos de acuerdo con la condición del insecto
muerto (Garrido-Jurado
et al., 2020), uno por transferencia conidial en placas de Petri con
contenido de medio de cultivo selectivo y el otro método, los insectos sin
crecimiento fúngico externo visible, se desinfestaron superficialmente y fueron
incubados en condiciones de cámara húmeda. Después de 7 a 10 días de incubación
a 25°C, se aislaron los hongos desarrollados. El ensayo se realizó por
triplicado. Se eligieron colonias que mostraron características compatibles a
los conocidos géneros de HE y algunos ocasionales hongos.
Identificación
y análisis moleculares
La
identificación de los hongos a nivel de género se realizó observando las
estructuras microscópicas de cada aislado, bajo microscopio óptico (Microscopio
Leica DM500 Alemania). Para la identificación de las estructuras fúngicas se
utilizó la llave de identificación propuesto por Barnett y Hunter (1998).
El aislamiento,
purificación e identificación morfológica se realizó en el laboratorio del Área
de Protección Vegetal de la FCA, UNA y la amplificación del gen e identificación
molecular de los aislados se realizó en el laboratorio
del Departamento de Agronomía, ETSIAM, Universidad de Córdoba, España.
El ADN total de
los aislados se extrajo a partir de micelio liofilizado siguiendo el método de
Raeder y Broda (1985). Se amplificó el gen del factor de elongación 1 α (EF-1α),
se secuenció y se analizó en cada uno de los aislados. La amplificación se
realizó con los cebadores tef1fw (50-GTGAGCGTGGTATCACCA-30) (O’Donnell et al.,
1998) y 1750-R (50-GACGCATGTCACGGACGGC-30) (Garrido-Jurado et al., 2011) con
las siguientes modificaciones: en un volumen total de reacción de 50 μl que contenía 1,5 μl de ADN genómico, 1X
DreamTaqTM buffer con MgCl2 (ThermoScientific, Waltham, MA, USA), 20 nM de cada
cebador, 40 nM de mezcla de dNTPs y 0,25 U de DreamTaqTM DNA polymerase (Thermo
Scientific, Waltham, MA, USA). Las condiciones de amplificación fueron las
descritas por Garrido-Jurado et al. (2011). Los productos de PCR se
visualizaron en gel de agarosa al 1%, se purificaron utilizando Geneclean II
kit system (QBiogene, Inc., Carlsbad, CA) y se secuenciaron por la empresa Stab
Vida (Caparica, Portugal). Se analizaron las secuencias EF1-α de los aislados y el
alineamiento entre estas y secuencias de la misma región de especies cercanas
se realizó usando el programa MegAlign [DNASTAR package, London, UK). El
análisis filogenético se llevó a cabo mediante el programa MEGA 11 (Tamura et
al., 2021). Se realizó el árbol de
máxima verosimilitud usando el criterio TBR (tree-bisection-reconnection), el
soporte de las ramas se hizo mediante un análisis de bootstrap de 1000
réplicas. Se utilizó una distribución discreta Gamma para calcular el modelo de
la tasa de cambio entre sitios (5 categorías (+G, parámetro = 0,1893)]. Hubo un total de 853 posiciones en el dataset
final. Para calcular la autocorrelación de tasas evolucionarias se ha utilizado
el método Corrtest (Tao et al., 2019).
Los datos generados sobre
incidencia de insectos micosados fueron sometidos a Análisis de Varianza
(ANOVA) y las medias por el test de Tukey (p≤ 0,05) (Statistix 10, Analytical
Software, 2013). La comparación de las poblaciones de hormigas cortadoras se
realizó mediante la prueba no paramétrica Kruskal-Wallis para muestras
independientes (SPSS 25).
Resultados y
Discusión
Efectos de los hongos entomopatógenos sobre insectos trampa
Las esporas
asexuales o conidios de los hongos entomopatógenos (HE) Beauveria sp.
y Metarhizium sp., son los responsables de la infección de insectos y
que se encuentran dispersos por el medio donde se encuentran sus hospedantes,
en este caso sobre las hormigas cortadoras de hojas. En los 20 nidos
muestreados, 10 nidos ubicados en áreas tratadas aplicación continua del
producto químico (Fipronil), tanto en la zona de la rizosfera como en el resto
del suelo, se han observado poblaciones de reinas aladas muertas por la
infección de Metarhizium sp. y Beauveria sp. (Tabla 1). Sin
embargo, no hubo diferencias significativas entre nidos o entre las muestras de
suelo y la rizosfera (a partir de ahora sitio) tanto para las reinas que
mostraron crecimiento de Metarhizium sp. (F9,19=1,95,
p>0.05 entre nidos; F1,19=4,31, p>0,05 entre sitios), de Beauveria
sp. (F9,19=0,94, p>0,05 entre nidos; F1,19=0,29,
p>0,05 entre sitios) o muertas por otras causas (F9,19=1,38,
p>0,05 entre nidos; F1,19=1,98, p>0,05 entre sitios) (Figura
5). Sin embargo, mostró diferencias significativas entre las dos situaciones de
las parcelas de muestreo tanto para variable hormigas colonizadas por el hongo
(H=114,249; p=0,0001) como hormigas muertas por otras causas (H=155,021;
p=0,0001) (Figura 6).
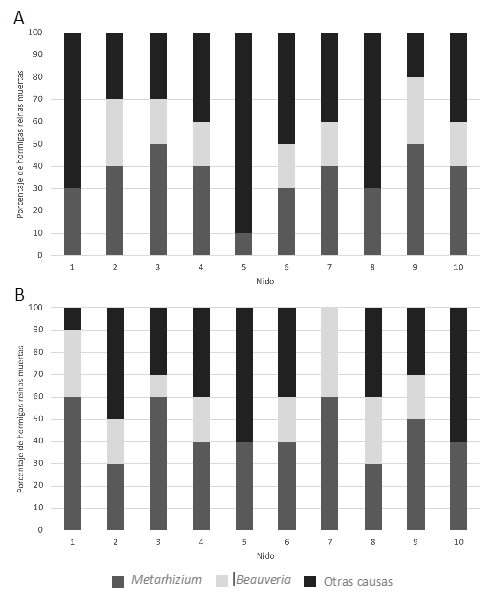
Figura 5. Porcentaje de hormigas
reinas encontradas muertas por infección fúngica con Metarhizium sp. y Beauveria
sp. o por otras causas para los 10 nidos ubicados en áreas de aplicación continua
de Fipronil. A) Aislando del resto del suelo; B) Aislando del suelo adheridas a
las raíces de las plantas.
En el caso de aquellas reinas que mostraron
crecimiento de Metarhizium sp., aunque las diferencias entre sitios no fueron
significativas, sí que se observó un mayor porcentaje de ellas en la zona de la
rizosfera (Figura 6). Esto concuerda con los trabajos de Hu y Leger (2002)
y Barelli et al. (2018) en los que indica que el género Metarhizium se encuentra
preferentemente en la zona de la rizosfera.
El análisis de
Kruskall-Wallis evidenció la ausencia de diferencias significativas entre los
nidos para la variable hormigas colonizadas por el hongo (H=2,463; p>0,05) y
para la variable muertas por otras causas (H=3,806; p>0,05), respectivamente
(Figura 6).
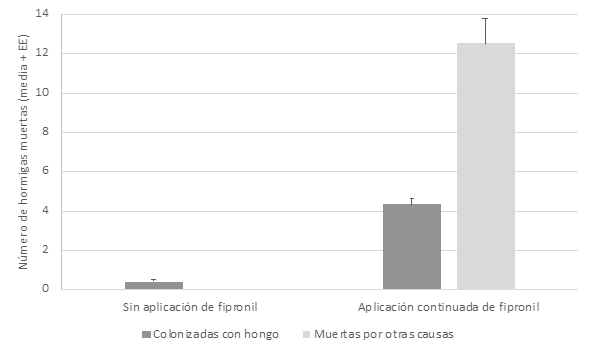
Figura 6. Número de hormigas
cortadoras encontradas muertas por infección fúngica o por otras causas en una
zona sin aplicación de Fipronil y en otra de aplicación continuada del mismo.
Se colectaron los individuos de 30 puntos presentes en la zona de
muestreo sin aplicación de Fipronil. Se encontraron un total de 368 ninfas
estando el 38 % (n=144) infectadas por hongos entomopatógenos, así como 31
adultos colonizados también por hongos entomopatógenos.
Tabla 1. Identificación de los aislados de hongos entomopatógenos
colectados del área de influencia de nidos de hormigas cortadoras.
|
Identificación/ aislados
|
Muestras s/ insectos trampas /Hospedantes
|
|
Suelo
|
Suelo adherida a las raíces
|
Insectos colonizados colectados del campo
|
|
Beauveria bassiana
|
x
|
x
|
x
|
|
Metarhizium sp.
|
|
|
|
|
|
x
|
x
|
x
|
|
|
|
|
|
|
|
Para la identificación molecular de los hongos aislados, se
obtuvieron dos aislados de los cadáveres de insectos pertenecientes a la
especie Beauveria bassiana (Figura 7) y un aislado del género Metarhizium.
Las secuencias obtenidas, secuencias de B. bassiana A y B. bassiana
B, han sido depositadas en GenBank con los números de acceso OR176989 y
OR176990, respectivamente. Ambas secuencias se alinearon y compararon con 20
secuencias obtenidas de la base de datos pertenecientes a las especies B.
bassiana, B. varroae, B. asiatica, B. australis, B. brongniartii, B.
pseudobassiana, B. caledonica, B. vermicornia, B. sungii, B. amorpha y Cordyceps
militaris. El árbol filogenético muestra como ambas secuencias se
encuentran recogidas en el cluster de B. bassiana soportado por un
bootstrap de 84 %, lo que haría necesario incluir más regiones
definitorias del género Beauveria como BLOC (Rehner et al., 2011). No se
rechazó la hipótesis nula de la tasa de independencia de las tasas evolutivas
entre linajes en la filogenia de la figura 7 (p>0,05). El análisis Corrtest
(Tao et al., 2019) arrojó una puntuación de 2,61x10-6 y el logaritmo
de verosimilitud del árbol evaluado es (-2146,49). En el Paraguay, existen
trabajos realizados sobre eficacia de productos formulados no nativos
utilizados contra Acromyrmex landolti fracticornis (Amarilla
Salinas y Arias Ruiz Día, 2011). En este trabajo, reportamos la identificación
de Beauveria bassiana y Metarhizium sp., dos especies obtenidas in
situ de las hormigas cortadoras de hojas (Atta sexdens). Ambas especies con origen
monofilético a las familias Cordycipitaceae y Clavicipitaceae perteneciente a
la Clase Ascomycetes
y Orden Hypocreales, respectivamente (Bischoff et al., 2009; Rehner et al., 2011).
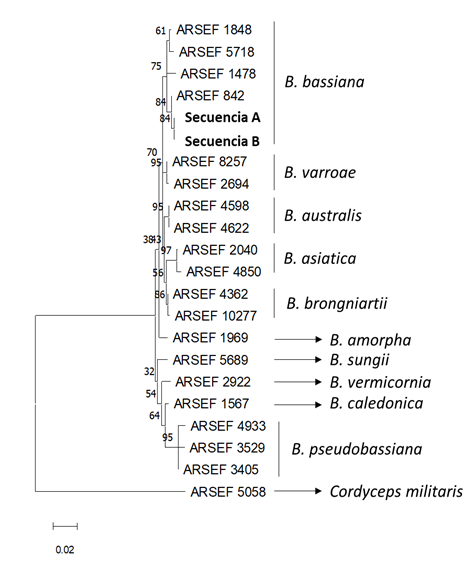
Figura 7. Árbol de máxima
verosimilitud basado en secuencias EF-1α. Las secuencias recién generadas para
el presente estudio están en negrita. Se muestra arriba de las ramas el
porcentaje de árboles en los que los taxones asociados se agruparon.
Conclusión
Se identificó
dos aislados de los hongos entomopatógenos Beauveria bassiana (A y B) y
un género Metarhizium sp. como potenciales controladores
biológicos de hormigas cortadoras (Atta sedens) in situ.
Fuente de financiamiento
Sin financiamiento externo.
Contribución de autores
Concepción del estudio: G.A.R.-R. Diseño del experimento: G.A.R.-R. Ejecución del experimento: G.A.R.-R., H.S.-O., M. V.
O. Verificación
del experimento: G.A.R.-R., H.S.-O., M. V. O. Análisis/interpretación de datos: G.A.R.-R., F.P.R.-S., K.
G., I.G.-J. Análisis
estadísticos: G.A.R.-R., F.P.R.-S., K. G., I.G.-J. Preparación del manuscrito: G.A.R.-R., S. C., I.G.-J. Edición y revisión del
manuscrito: G.A.R.-R.,
S. C., Aprobación
de la versión final del manuscrito: G.A.R.-R., H.S.-O., F.P.R.-S., F.P.R.-S., M. V. O., K. G., I.G.-J.
Referencias
Bibliográficas
Amarilla Salinas, E. y Arias Ruiz Díaz, O. R. (2011). Control de
la hormiga cortadora “Akeke” Acromyrmex landolti con hongos
entomopátogenos. Investigación Agraria, 13 (1), 27-32.
Barelli, L.,
Moreira, C. C. & Bidochka, M. J. (2018). Initial stages of
endophytic colonization by Metarhizium involves rhizoplane colonization. Microbiology, 164(12),
1531-1540.
Barnett,
H. y Hunter, B. (1998). Illustrated genera of imperfect fungi. APS PRESS.
The American Phytopathological Society. Minnesota, EE.UU. pp 217.
Bischoff,
J. F., Rehner, S. A. y Humber, R. A. (2009). A multilocus phylogeny of the Metarhizium
anisopliae lineage. Mycologia, 101(4), 512-530. doi: 10.3852/07-202.
Garrido-Jurado,
I., Márquez, M., Ortiz-Urquiza A., Santiago-Álvarez, C., Iturriaga, E. A.,
Quesada-Moraga, E., Monte, E. & Hermosa, R. (2011). Genetic analyses
place most Spanish isolates of Beauveria bassiana in a molecular group
with word-wide distribution. BMC Microbiology, 11, 84.
Garrido-Jurado,
I., Resquín-Romero, G., Yousef-Naef, M., Ríos-Moreno, A. & Quesada-Moraga,
E. (2020). Soil drenching with entomopathogenic fungi for control of the
soil-dwelling life stages and adults of the same generation of Spodoptera
littoralis (Boisd.) (Lepidoptera: Noctuidae). Boletín de investigaciones
entomológicas. Universidad de Cambridge, 110 (2), 242-248.
Gryganskyi,
A. P., Humber, R. A., Smith, M. E., Hodge, K., Huang, B., Voigt, K. &
Vilgalys, R. (2013). Phylogenetic lineages in Entomophthoromycota. Persoonia, 30,
94-105.
Hibbett,
D. S., Binder, M., Bischoff, J. F., Blackwell, M., Cannon, P. F., Eriksson, O.
E., Huhndorf, S., James, T., Kirk, P. M., Lucking, R., Lumbsch, H. T., Lutzoni,
F., Matheny, P. B., McLaughlin, D. J., Powell, M. J., Redhead, S., Schoch, C.
L., Spatafora, J. W., Stalpers, J. A.,… Zhang, N. (2007). A higher-level
phylogenetic classification of the Fungi. Mycological Research, 111, 509-547.
Atta
sexdens (Linnaeus, 1758) in GBIF Secretariat (2023). Global
Biodiversity Information Facility (GBIF) Backbone Taxonomy. Checklist dataset.
https://doi.org/10.15468/39omei accessed via GBIF.org on 2023-11-20.
Hu,
G. & Leger, R. J. S. (2002). Field studies using a recombinant
mycoinsecticide (Metarhizium anisopliae) reveal that it is rhizosphere
competent. Appl. Environ. Microbiol., 68(12), 6383-6387.
Humber,
R. A. (2012). Entomophthoromycota: a new phylum and reclassification for
entomophthoroid fungi. Mycotaxon, 120, 477-492.
O’Donnell
K, Cigelnik E. & Nirenberg H. I. (1998). Molecular systematics and
phylogeography of the Gibberella fujikuroi species complex. Mycologia, 90, 465-493.
Quesada-Moraga,
E., Navas-Cortes, J. A., Maranhao, E. A. A., Ortiz-Urquiza, A. & Santiago
Alvarez, C. (2007). Factors affecting the occurrence and distribution of
entomopathogenic fungi in natural and cultivated soils. Mycological Research, 111, 947-966.
Raeder, U. y
Broda, P. (1985). Preparación rápida de ADN a partir de hongos filamentosos. Applied
Microbiology. 1, 17-20. https://doi.org/10.1111/j.1472-765X.1985.tb01479.x.
Rehner,
S. A., Minnis, A. M., Sung, G. H., Luangsa-ard, J. J., Devotto, L. &
Humber, R. A. (2011). Phylogeny and systematics of the anamorphic,
entomopathogenic genus Beauveria. Mycologia,103, 1055-1073.
Statistix
10, Analytical Software. (2013). https://www.statistix.com/
Tamura,
K., Stecher, G. & Kumar, S. (2021). MEGA 11: Molecular Evolutionary
Genetics Analysis Version 11. Molecular Biology and Evolution, 38(7),3022-3027.
https://doi.org/10.1093/molbev/msab120.
Tao,
Q., Tamura, K., Battistuzzi, F. & Kumar, S. (2019). A Machine Learning
Method for Detecting Autocorrelation of Evolutionary Rates in Large
Phylogenies. Molecular Biology and Evolution, 36(4), 811-824.
Zimmermman,
G. (1986). The Galleria bait method for detection of entomopathogenic
fungi in soil. Journal of Applied Entomology, 102, 213-215.

![]() 10.57201/ieuna2323340
10.57201/ieuna2323340![]() , Universidad Nacional
de Asunción.
, Universidad Nacional
de Asunción.![]() , Centro de Desarrollo e Innovación Tecnológica (CEDIT)
, Centro de Desarrollo e Innovación Tecnológica (CEDIT)![]()
![]() *, Humberto
Sarubbi-Orue1
*, Humberto
Sarubbi-Orue1![]() , Fanni Petrona Ruiz-Samudio1
, Fanni Petrona Ruiz-Samudio1![]() , Sergio Manuel Chamorro-Diaz1
, Sergio Manuel Chamorro-Diaz1![]() , Mirtha Vera de Ortiz2
, Mirtha Vera de Ortiz2![]() , Katarzyna Golan3
, Katarzyna Golan3![]() , Inmaculada Garrido-Jurado4
, Inmaculada Garrido-Jurado4![]()






