ARTÍCULO
ORIGINAL Ingeniería
y Tecnología

 10.57201/ieuna2413255
10.57201/ieuna2413255
Sección: Artículo original
*Autor correspondiente: rocicoronel99@gmail.com
Editor de área:
Jorge Rodas , Universidad
Nacional de Asunción.
, Universidad
Nacional de Asunción.
Recibido:
21 de marzo de 2023
Aceptado:
22 de mayo de 2023
Recibido en versión modificada:
18 de julio de 2023
Este
es un artículo publicado en acceso abierto bajo una Licencia Creative Commons “CC BY 4.0”. 
Declaración de conflicto: Los
autores declaran no tener conflicto de intereses.
e-ISSN
2709 -0817
Como citar: Coronel
Cristaldo,R. N., Santander Díaz, L. D. y Troche Rotela, A. (2024).Diseño para
la optimización de un Biorreactor tipo koji destinado a producción de biomasa fúngica
mediante fermentación en estado sólido.. Revista investigaciones
y estudios – UNA, 15(1), 12-26.
Diseño
para la optimización de un Biorreactor tipo Koji destinado a producción de
biomasa fúngica mediante fermentación en estado sólido
Optimized design of a Koji-type Bioreactor for the
production of fungal biomass through solid-state fermentation
Rocío
de las Nieves Coronel Cristaldo1 *,
Laura Denisse Santander Díaz1
*,
Laura Denisse Santander Díaz1 ,
Abdón Troche Rotela2
,
Abdón Troche Rotela2
1Universidad Nacional de
Asunción. Facultad de Ciencias Exactas y Naturales. Departamento de
Biotecnología. Laboratorio de Biotecnología Vegetal. Cátedra de Biotecnología I
(Biorreactores). San Lorenzo, Paraguay.
2Universidad Nacional de
Asunción. Facultad Politécnica. San Lorenzo, Paraguay.
Resumen. Los
reactores biológicos aplicados a la producción industrial de bioproductos de
interés comercial son una herramienta cada vez más aprovechada y, a partir de
esto, ha surgido la necesidad de estudiar la ingeniería aplicada al diseño y
construcción de los biorreactores para maximizar el rendimiento de los procesos
biológicos que ocurren en él. El análisis de los métodos y herramientas para el
control de parámetros básicos y su ajuste de acuerdo al tipo de microorganismo
en estudio ha sido el principal interés de esta ciencia, así como también la
facilidad con la que se pudieran resolver los inconvenientes que tienen lugar
durante el proceso de fermentación. Los biorreactores de operación en estado
sólido presentan numerosas ventajas en la utilización para la producción de
biomasa fúngica debido a la facilidad en el montaje del mismo y control de
condiciones de operación. Con el objetivo de la optimización de un reactor
existente para procesos de fermentación, se ha buscado un diseño que posibilite
la producción de biomasa fúngica de T. asperellum con un control óptimo
de la asepsia del cultivo y los parámetros físicos del proceso.
Palabras clave: reactor
biológico, biofermentación, bioingeniería.
Abstract.
Biological reactors applied to the industrial
production of bioproducts of commercial interest have been an increasingly used
tool which led to the study of engineering methods such as the design and
construction to maximize the performance of the processes that take place
inside of the bioreactor. The analysis of the methods and tools for the control
of basic parameters and their adjustment according to the type of microorganism
has been the main interest of this field of study, as well as the ease with which
the inconveniences that occur during the fermentation process can be resolved.
Solid-state operation bioreactors have many advantages in the production of
fungal biomass due to the easiness of assembly and operating control
conditions. The aim of this project was the design and optimization of an
existing bioreactor that allows the production of T. asperellum
fungal biomass with an optimal control of the asepsis and physical factors of
fermentation.
Keywords:
biological reactor, biofermentation,
bioengineering.
Introducción
En la
actualidad los procesos fermentativos y biotecnológicos tienen gran
importancia, y la aplicación sistematizada de biorreactores en esta área es
decisiva, así como sus características particulares. La producción de biomasa a
través de esta tecnología, utilizada desde la década de los noventa, ha
presentado inconvenientes que arroja resultados ineficientes debido
principalmente a inconveniencias técnicas y tecnológicas a superar (Marín
Cárdenas et al., 2008).
Desde
los años 70, el cultivo de microorganismos ha ido en aumento, ya que, a partir
de estos, es posible la producción de incontables metabolitos de valor añadido,
con aplicación química, nutricional, farmacéutica, etc., así como la obtención
de biomasa para una alternativa a los combustibles fósiles o para la obtención
de bio productos (Moreno y Vanegas, 2017).
Un
biorreactor constituye un equipo utilizado para la puesta en marcha de una o
más reacciones biológicas, a escala piloto y especialmente a escala industrial.
Se considera el corazón de un proceso biológico, ya que este es quién
proporciona las condiciones de operación adecuadas para que el microorganismo
se desarrolle y/o produzca un compuesto bioactivo deseado (Ruíz-Leza et al.,
2007).
Los
biorreactores más utilizados a nivel industrial están provistos de mecanismos
de agitación, dispersión y aireación, así como de sistemas para el control de
la temperatura, humedad y pH. Los criterios para el diseño de un biorreactor se
basan en el tipo de equipo (tambor, columna, charola, etc.) y la fermentación a
llevarse a cabo (sólido o líquido) (Ruíz-Leza et al., 2007). Durand (2003)
también hace referencia a la importancia del sustrato utilizado, donde la
composición, el tamaño y la capacidad de retención de agua son parámetros
importantes a tener en cuenta.
La
fermentación en estado sólido (FES) es un proceso en el que los microorganismos
crecen en un ambiente sin agua libre o prácticamente mínima. Ha sido foco de
estudio en las últimas décadas atendiendo a que permite el uso de residuos
sólidos agroindustriales como sustrato en su forma natural y facilita el manejo
de los residuos sólidos, además de que presenta una menor producción de aguas
residuales (Soccol et al, 2017).
Las
técnicas relacionadas a la FES tuvieron origen en Asia para la producción de
alimentos, en los años ochenta recuperó el interés de la comunidad científica,
tal es así que posteriormente se desarrollaron algunos modelos de biorreactores
para estudios a escala de laboratorio. Y si bien los biorreactores de FES poseen
sus ventajas y desventajas definidas, hasta la fecha continúa el desarrollo de
mejores diseños en respuesta a la demanda de nuevos procesos biotecnológicos
llevados a cabo en este tipo de equipo (Vandenberghe et al., 2021).
Los
avances publicados en países occidentales en relación a la utilización de
fermentación en estado sólido han sido numerosos, y esto se debe principalmente
a que el proceso se adapta con éxito al metabolismo de hongos, que son los
microorganismos más comunes en los procesos FES (Durand, 2003) aunque también
se reporta la producción de metabolitos secundarios mediante bacterias como Streptomyces
sp., Bacillus thuringiensis y Bacillus subtilis (Robinson et al, 2002).
La
utilización de la fermentación en estado sólido apunta principalmente a
incrementar la productividad de las fermentaciones, ya que se ha observado que
posee un alto rendimiento en períodos de tiempo cortos, facilidad en la
separación del producto del sustrato empleado y, a la vez, representa una
inversión económica accesible (Robinson et al., 2002).
Estado
actual del tema
La FES
consiste en el crecimiento de microorganismos sobre materiales sólidos húmedos.
A partir de este punto de vista, las condiciones de cultivo no presentan un
nivel de esterilidad alto, pero constituyen procesos de bajo contenido de agua
y energía, y bajo costo económico, por lo que resultan fáciles de escalar, y a
esto se suma el hecho de que el cultivo en sustratos sólidos naturales
proporciona una cantidad muy elevada de nutrientes esenciales para el
crecimiento de los microorganismos, facilitando así su desarrollo (Rodríguez Pérez
et al., 2017).
Los
biorreactores en bandeja usualmente poseen un diseño muy simple, sin aireación
forzada ni mezcla para el sustrato sólido, por lo que son reactores
restrictivos en cuanto a la cantidad de sustrato que se puede fermentar, y la
parte inferior de las bandejas está perforada para permitir la aireación del
sustrato sólido, con cada bandeja dispuesta encima de la otra (Robinson y
Nigam, 2003).
Muchos
productos emplean "cultivos iniciadores" que se cultivan en FES y
estos suelen ser considerados como uno de los ingredientes para preparar un
amplio conjunto de productos, tales como licores, vinagre, salsa de soja,
bebidas destiladas, entre otros, principalmente en los países occidentales,
donde es habitual nombrar a todos estos cultivos iniciadores como
"Koji", sin embargo, existen clasificaciones específicas, como el
"Qus chino" o el "Nuruk coreano", siendo el Koji de origen
japonés. En la mayoría de los casos, el papel de estos iniciadores es producir
reservas enzimáticas para hidrolizar macromoléculas de sustrato (Soccol et al.,
2017).
Se han
reportado numerosos trabajos relacionados al estudio de la FES para obtención
de enzimas por Aspergillus niger (Costa et al., 2012), crecimiento para Pleurotus
ostreatus sobre pulpa de café (Rodríguez Pérez et al., 2017), producción de
la biomasa proteica a partir de Candida utilis (Marín Cárdenas et al.,
2008), entre otros.
Método
de operación
El
biorreactor tipo Koji opera en forma discontinua en condiciones estáticas. Se
trata de una cámara cerrada que posee bandejas de acero de 33x43x5 cm (longitud
x profundidad x altura) con pequeños orificios para la circulación de aire, en
las que se dispone el sustrato inoculado. Es necesario acoplar sistemas
electrónicos a modo de realizar un control sobre los parámetros de
fermentación, principalmente temperatura y humedad (Soccol et al., 2017; Manan
y Webb, 2020).
Análisis
de las variables de
fermentación
Teniendo
en cuenta que la FES en un biorreactor intenta imitar las condiciones de
hábitat natural de los microorganismos, los más adecuados para este tipo de
tecnología son los hongos filamentosos. Estos poseen la característica de ser
bastante flexibles en cuanto sus requerimientos fisicoquímicos y ser
resistentes a condiciones no tan favorables (Socco et al., 2017; Vandenberghe
et al., 2021).
Temperatura
Los
hongos son organismos mesófilos y cada especie posee diferentes requerimientos
nutricionales, así como también condiciones favorables que maximizan la
esporulación (Sandoval Vega y Noelthing Zenobio, 2011). Las temperaturas
óptimas para el crecimiento de las especies de Trichoderma rondan los 25
a 30 grados Celsius (Vásquez, 2010; Pineda-Insusasti et al., 2017).
Iluminación
Se han
reportado numerosos estudios acerca de la incidencia del fotoperiodo en el
crecimiento de especies fúngicas, no encontrándose efectos significativos sobre
el mismo (Silva et al., 2013), sin embargo, se ha evidenciado la influencia de
la luz sobre la formación de conidios más resistentes en algunas especies de
Trichoderma (González, 2000), incluso estableciéndose que la oscuridad inhibe
la conidiogénesis (Vásquez, 2010).
Humedad
Durante
la FES el microorganismo crece sobre un sustrato al cual s e adhiere. Este
sustrato no presenta agua libre en su estructura, pero existe un requerimiento
de humedad para satisfacer las necesidades básicas del microorganismo (Costa et
al., 2012). También un parámetro a tener en cuenta es la capacidad de absorción
de agua del sustrato utilizado. Para la mayor parte de organismos del reino
Fungi el contenido de humedad requerido varía entre 40-70% (Vandenberghe et
al., 2021).
Sustratos
Los
sustratos frecuentemente utilizados para la fermentación en estado sólido son
residuos agroindustriales (Vandenberghe et al., 2021), por lo que representan
una alternativa ecológica para el manejo de los mismos. Su composición puede
ser muy variable, en general, materiales lignocelulósicos como harinas con alto
contenido en almidón (Rodríguez Pérez et al., 2017). También se ha reportado
que la utilización de diferentes sustratos sólidos para la producción de Trichoderma
spp. a nivel industrial y semiindustrial tales como cebada, olote o arroz
(Chávez-García et al., 2008).
El
sustrato más utilizado y con mayores índices de producción de biomasa para
cepas del género Trichoderma es el arroz, por lo que se decidió utilizar
como un control positivo, en relación al olote de maíz que representa un
subproducto de la industria agroalimentaria predominante en el país.
Sistemas
de medida
Desde
un punto de vista analítico, la cuantificación de biomasa fúngica puede ser
realizada de forma directa, mediante métodos gravimétricos como peso seco. Sin
embargo, en FES, resulta un poco inapropiado pues existe una interacción fuerte
entre el micelio y el sustrato, y dependiendo del que sea utilizado, es posible
que se produzca un arrastre del mismo al momento de la separación,
introduciéndose de esta forma errores en la cuantificación. Es posible reducir
estos errores empleando un método basado en la determinación
espectrofotométrica, lo cual también mejora la rapidez de dicha evaluación
(Rodríguez Pérez et al., 2017). A su vez, es posible realizar conteo de esporas
a partir de sustrato fermentado seco en diluciones. Este método se realiza en
hemocitómetros (Manan y Webb, 2020).
Materiales
y Métodos
Diseño
del biorreactor
Partiendo
desde el armazón diseñado y construido por alumnos de la cátedra de
Biotecnología I (Biorreactores) de la Licenciatura en Biotecnología de la Facultad
de Ciencias Exactas y Naturales de la Universidad Nacional de Asunción en el
año 2019, se realizó un nuevo diseño experimental en base a los requerimientos de Trichoderma asperellum
TF7.
El
suministro de temperatura se realizó mediante la aplicación de una estructura
obtenida por impresión 3D de un adaptador para el microventilador acoplado a
una lámpara incandescente de 12W. Mientras que la humedad se proporcionó por
medio de un humidificador de marca Satellite A-H6605, se diseñó e imprimió un
adaptador de dos canales para la conexión de dos mangueras de PVC transparentes
a las entradas del fermentador que daban por encima de las bandejas y las
conexiones fueron aseguradas con cintillos de plástico.
Todas
las partes no electrónicas del equipo ensamblado, así como las dos bandejas de
fermentación fueron previamente desinfectadas con lavados sucesivos de
hipoclorito de sodio al 1%, agua destilada y alcohol 70%. Por otro lado, la
estructura de caja fue desinfectada con
2-fenilfenol 0,1% y etanol 54% del desinfectante aerosol Lysoform® antes y después de su uso.
El
sistema de control temperatura y humedad fue por medio de un sensor instalado
en la parte superior del fermentador, éste se encontraba conectado a un
controlador STC-3028. Por medio de las instrucciones del fabricante, se ajustó
el rango de temperatura 25-28 grados Celsius y humedad 80-90%, óptimos
para T. asperellum TF7.
Se
aplicó un fotoperiodo de luz 6500K continua (24 horas) para el cual se utilizó 5 metros
de cinta LED tipo SMD2835 con un voltaje de 12V durante todo el proceso.
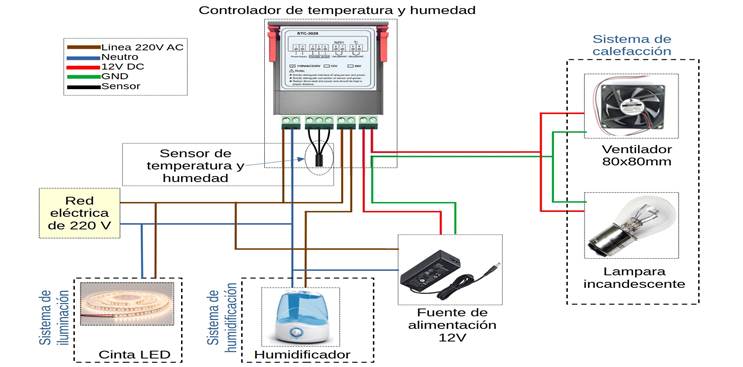
Figura
1. Esquema eléctrico
del biorreactor. Partes del sistema eléctrico del biorreactor.
Figure 1. Electrical diagram of the
bioreactor. Electrical parts of the bioreactor system.
Controlador
de temperatura y humedad: Es el
modelo STC-3028 que consta de una interfaz dual LED para las dos magnitudes que
controla y además de una botonera de programación.
El
controlador consta de una fuente de alimentación interna de Corriente Alterna
de 110-220 V y 50/60 Hz. Las magnitudes que mide son la temperatura y la
humedad. El rango de temperatura de medición es de -20 °C ~ +80 °C y el rango
de medición de humedad es de 00 % HR~+100 % HR.
El
controlador tiene una precisión de ±1°C 0,1%HR. La capacidad de contacto de
salida de relé es de 10A. Este controlador consta de un sensor integrado,
longitud de línea de 1 metro.
El
material de la carcasa del controlador es de plástico ignífugo ABS y tiene un
peso neto 120 g y un peso bruto 140 g.
Las
características del controlador son:
1. Capacidad de controlar la temperatura y la humedad al
mismo tiempo.
2. Capacidad de conectarse con equipos de
refrigeración/calefacción y humidificador/deshumidificador al mismo tiempo.
3. La función de calefacción/refrigeración se puede
configurar por separado para proteger el controlador de temperatura de cambios
violentos. Igual que el control de humedad.
4. Compatibilidad con la calibración de temperatura y
humedad.
5. Ventana de visualización doble. Con capacidad de mostrar
la temperatura/humedad medida y configurar la temperatura/humedad al mismo
tiempo.
Sensor
de temperatura y humedad:
El módulo digital de temperatura y humedad AM2120 es un sensor compuesto de
temperatura y humedad con una salida de señal digital calibrada. Aplica
tecnología de adquisición de módulo digital especial, temperatura y tecnología
de detección de humedad, para garantizar que el dispositivo tenga una alta
confiabilidad y una excelente estabilidad a largo plazo. El sensor tiene las
ventajas de una excelente calidad, una respuesta ultrarrápida, una gran
capacidad anti-interferencias y una alta rentabilidad. Cada sensor está
calibrado de forma precisa, los coeficientes de calibración se almacenan en
forma de programa en la computadora de un solo chip y se denominan en el
proceso de procesamiento de la señal de detección dentro del sensor. La
interfaz de bus único estándar hace que la integración del sistema sea fácil y
rápida. Debido al tamaño ultra pequeño y el consumo de energía muy bajo, la
distancia de transmisión de la señal puede alcanzar más de 20 metros, lo que la
convierte en la mejor elección para todo tipo de aplicaciones e incluso las
aplicaciones más exigentes.
Sistema
de calefacción: El
sistema de calefacción consta de 12v 21W lámpara y un ventilador de 12 V de
alta calidad con doble rodamiento de bolas y tecnología sin escobillas. Los
materiales principales están hechos de PBT termoplástico. El tamaño del
ventilador es de 80x80x25mm, sus valores de tensión nominal de 12 VCC con una
corriente nominal de 0.2A y un consumo de energía nominal de 2,4W. El flujo de
aire de 12,18 CFM (pies3/min) ~ 36,48 CFM (pies3/min) y un nivel de ruido de
<10dB(A) ~ <33dB(A).
Sistema
de humidificación: El
dispositivo humidificador es ultra-silencioso, y su diseño permite el ahorro de
energía. Consta de ajuste de niebla suave y se apaga automáticamente cuando el
tanque está vacío. Consta con las lámparas empotradas para la mejor
visualización del líquido. El dispositivo tiene un indicador de humidificación
que permite cambiar y ajustar el humidificador según el volumen de niebla
necesario.
Sistema de iluminación: El sistema de iluminación consiste en
una cinta LED cuyas especificaciones son las que siguen; es de color blanco
similar a luz diurna con temperatura de color 6000-6500K. La cinta consta de
LEDs del tipo 2835 de un solo color cuya cantidad de LEDs son de 300 piezas. La
longitud de la tira de luz es de 5 metros. Tiene 2140 lúmenes y un ángulo de
radiación 120°. Consta de protección de ingreso IP20. Su adaptador de corriente
tiene una potencia de 24W y un voltaje de trabajo de 12V Corriente Continua de
salida y un voltaje de entrada 100-240 V Corriente Alterna a una frecuencia de
50/60 Hz.
Producción del hongo Trichoderma
asperellum en sustrato sólido dentro del biorreactor
Sustrato y tratamiento
Se lavaron los sustratos arroz
parbolizado y 14 olotes de maíz (Amaro et al., 2015), tres veces con agua de
canilla y luego tres veces con agua destilada. Posteriormente, se llevó a cabo
la molienda de los olotes de maíz previamente cortados en partes pequeñas para
facilitar el triturado. Una vez obtenido el triturado de los olotes se llevó a
estufa durante 4 horas a 90°C (Palacios-Rojas, 2018), luego se procedió a
colocar tanto los granos de arroz como el triturado de olotes en frascos de vidrios
previamente desinfectados y se autoclavó durante 15 minutos a 121°C para
después ser distribuidos 600 gramos en cada una de las bandejas. El arroz
parbolizado fue suplementado con melaza al 1% para acelerar el proceso de
fermentación pues esta presenta nutricionalmente un contenido alto en hidratos
de carbono simples y azúcares, además de vitaminas del grupo B y muchos
minerales, entre los que se acentúan el hierro, el magnesio y el cobre, los
cuales son elementos esenciales para los requerimientos nutricionales de Trichoderma.
Asimismo, Trichoderma utiliza como fuente de nitrógeno algunos
compuestos tales como aminoácidos, sulfatos y nitritos, los que se encuentran
presentes como componentes de la melaza (Allori et al., 2017).
Condiciones
de la fermentación
Se definieron 3 parámetros a controlar
durante el proceso de fermentación. El parámetro de temperatura fue definido
entre 25 y 28 grados Celsius. También se realizó control sobre la humedad del
ambiente establecida entre 80 y 90%. El parámetro de fotoperiodo fue definido
en luz blanca continua (24 horas) durante todo el proceso, llevado a cabo con
luces LED. Dos de estos parámetros (temperatura y humedad) fueron monitoreados
mediante el controlador STC-3028 con sensor propio.
El
sistema de suministro de humedad a través del humidificador fue realizado con
agua destilada y recargado en tres ocasiones, mientras que el ensamblaje del
microventilador a la lámpara incandescente fue cubierto por un pedazo de papel
en la parte posterior a modo de inducir una mayor generación de calor.
Inoculación
Dentro
de la cabina de flujo laminar del laboratorio de Biotecnología Industrial se
dispusieron en bandejas diferentes, los sustratos olote de maíz triturado y
arroz. A ambos se le agregaron 25 explantes de T. asperellum TF7,
respectivamente. Ambas bandejas fueron cerradas con papel aluminio para su
transporte hasta el fermentador y una vez introducidas, se conectó el sistema
completo al tomacorriente.
Resultados y Discusión
Ensamblaje
de las partes de biorreactor.

Figura 2. Esquema del funcionamiento del
biorreactor.
Figure 2. Diagram of the operation of
the bioreactor.
1. Gabinete del biorreactor: Es la parte principal del equipo y
está construido en acero. Tiene un tamaño de 35x45x45 cm (longitud x
profundidad x altura) y 2 cm de grosor. En su interior se encuentran las
bandejas soportadas por una estructura desmontable donde se colocan el sustrato
y el hongo para su inoculación, además está instalado el sistema de iluminación
y el sensor de temperatura y humedad. Consta de una puerta capaz de ser cerrada
herméticamente y en el centro de la misma tiene un cristal para la
visualización del proceso y su control.
2. Controlador de temperatura y humedad: Este dispositivo está en la parte
superior del gabinete para su visualización óptima. En sus bornes están
conectados los cables de alimentación con energía eléctrica alterna 220V 50 Hz,
el cual permite el encendido del controlador; y también se encuentra conectado
el sensor de temperatura y humedad. Para cada magnitud física a controlar el
controlador consta de un display y un relé de control. En su display se
visualiza la temperatura medida en Celsius y la humedad medida en porcentaje.
Tiene un sistema de control ON/OFF que le permite mantener los parámetros
controlados en un rango específico, que son configurados por el operador del
biorreactor.
3. Sensor de temperatura y humedad: Este dispositivo está ubicado en el
interior del biorreactor, adherido a la parte superior de las bandejas con una
cinta doble faz. El cable del sensor tiene salida por un orificio superior para
poder conectarse al controlador y medir estos parámetros.
4. Sistema de iluminación: Por medio de una cinta LED que se
encuentra encendida permanentemente durante todo el proceso biológico. La cinta
LED está energizada con 12 V con un adaptador o fuente de energía que convierte
la corriente alternada de 220v a corriente continua de 12V.
5. Mangueras transparentes de PVC: Permiten la unión del humidificador al
gabinete a través de dos orificios en el costado derecho del mismo. Es
transparente solamente con el propósito de verificar que no haya condensaciones
de la niebla o vapor frío de agua.
6. Sistema de humidificación: Consta del humidificador y un
adaptador para bifurcar a las mangueras de PVC, el equipo genera vapor frío
utilizando oscilaciones de ultrasonido. El dispositivo humidificador al estar
diseñado para usar en piezas grandes no necesita un ventilador extra para
introducir la humedad dentro del biorreactor, haciendo práctica su
implementación. El reservorio que tiene el humidificador permite largas horas
de humidificación sin necesidad de estar recargando de forma frecuente.
7. Sistema de calefacción: Consta de tres piezas principales para
su funcionamiento, la primera es el ventilador o cooler que aspira aire frío
del entorno para hacerlo pasar por la segunda pieza que es una lámpara
incandescente, la cual se calienta al encenderse, y finalmente la tercera parte
es un adaptador que fija el sistema a un orificio al costado del biorreactor y
finalmente pasando al interior del biorreactor el aire calentado causando el
aumento de la temperatura interior del biorreactor. El sistema está en contacto
con un relé del controlador que apaga y enciende según la necesidad del
dispositivo. El conjunto se alimenta con un voltaje continuo de 12V que sale
del adaptador de energía.
8. Adaptador de energía: Es el conversor de corriente alterna
de 220V a corriente continua 12V que son necesarias para el funcionamiento de
la cinta LED y el sistema de calefacción.
Crecimiento
del hongo Trichoderma asperellum mediante el biorreactor
Se
observa el sustrato olote de maíz triturado (Figura 3) y los granos de arroz
parbolizado (Figura 4) en la hora 0 del proceso de fermentación, luego del
pre-tratamiento de los mismos para asegurar su esterilidad.
Figura
3. Sustrato olote
inoculado con Trichoderma asperellum TF7 al inicio de la fermentación.
Figure
3. Crushed
corn cob substrate inoculated with Trichoderma asperellum TF7 at the
start of the fermentation.

Figura
4. Inoculación de los
explantes de Trichoderma asperellum TF7 en el sustrato arroz-melaza.
Figure 4. Inoculation of the explants
of Trichoderma asperellum TF7 in the rice-molasses substrate.
Se
registró el crecimiento del hongo de color verdoso en el olote de maíz a las 72
horas de ser inoculado (Figura
5), mientras que el arroz parbolizado suplementado con melaza al 1% a las 48
horas (Figura 6).
La
fermentación se llevó a cabo durante 72 horas y se pudo observar un crecimiento
de biomasa elevado debido a las condiciones de fermentación utilizadas que
fueron óptimas, tal como lo mencionan otros autores en sus pruebas de efecto y
temperatura de la luz en aislados de Trichoderma spp.

Figura
6. Crecimiento de Trichoderma
asperellum TF7 en olote de maíz triturado.
Figure 6. Growth of Trichoderma
asperellum TF7 in crushed corn cob.

Figura 5. Crecimiento de Trichoderma
asperellum TF7 en arroz parbolizado suplementado con melaza al 1%.
Figure 5. Growth of Trichoderma
asperellum TF7 in parboiled rice supplemented with 1% molasses.
A final
de la fermentación se obtuvo 17,6 y 17,7 g de esporas secas para olote de maíz
y arroz- melaza, respectivamente, separadas del sustrato mediante un proceso de
tamizado. A partir de esto, se realizó una serie de diluciones para el conteo
de esporas del hongo, donde se puede observar que el sustrato arroz-melaza
produce una mayor cantidad de esporas (Figura 7).
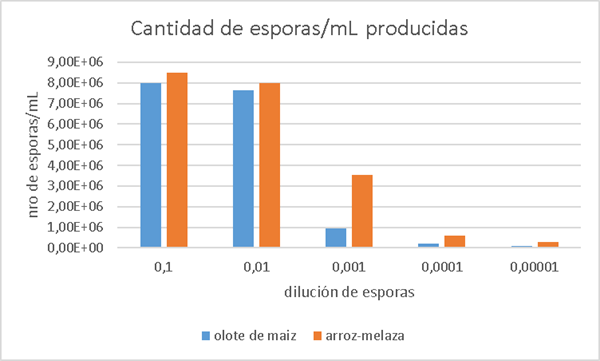
Figura
7. Comparación entre
las esporas observadas en cada una de las diluciones de ambos sustratos.
Figura 7. Comparison between the spores observed in each of the
dilutions of both substrates.
El
proceso se realizó mediante cámara de Neubauer y las diluciones de esporas se
realizaron con Tween 20 a partir de la biomasa obtenida por tamización de los
sustratos.
Si
bien la cantidad de biomasa en peso seco obtenida es mayor en el sustrato olote
de maíz, se observó una mayor cantidad de esporas obtenidas en el sustrato
arroz-melaza. Esto se debe a que, durante el proceso de separación por
tamizado, parte de la biomasa del olote fue arrastrada, mientras que el
tamizado en el sustrato arroz-melaza fue más eficiente.
Conclusión
El
diseño desarrollado fue capaz de cumplir con los requisitos de un proceso
fermentativo: control eficiente de los parámetros temperatura y humedad durante
todo el proceso. No obstante, no fueron analizados los parámetros de transferencia
de oxígeno y agitación, que se consideran puntos débiles de los sistemas de
fermentación en estado sólido.
Si
bien el tipo de biorreactor demanda una menor energía para la esterilización
debido a su diseño, los dispositivos utilizados para el montaje del biorreactor
permitieron un control relativamente alto de esterilidad. Las limitaciones en lo que se refiere a
la esterilización de un biorreactor tipo Koji debido a que son equipos de gran tamaño lo que dificulta
la esterilización por autoclavado, y hechos de material corrosible que no
pueden ser esterilizados fácilmente mediante métodos químicos convencionales representa una desventaja al momento de
realizar una fermentación en estado sólido. Una de las alternativas para
mitigar este inconveniente es la implementación de una combinación de distintas
técnicas de desinfección para evitar contaminaciones durante la inoculación o
los procesos de muestreo para medición de biomasa.
También
es importante resaltar que un paso fundamental antes de realizar el proceso de
inoculación es el pretratamiento de los sustratos a utilizarse pues esto supone
una forma de biodisponer los nutrientes que requieren los microorganismos para
su crecimiento.
El
sistema se caracteriza por ser flexible en cuanto a modificaciones para una
mayor optimización, siendo posible el acople de un sistema de registro de datos
durante todo el tiempo de fermentación.
Perspectivas
a futuro del BR en bandeja y aplicaciones
El
diseño de biorreactores a escala piloto es de gran interés debido a que
permiten modelar más a fondo los procesos biológicos asociados al uso de estos
equipos y facilita la realización de procesos de escalado con mayor eficiencia.
Detrás
de los productos de interés comercial que pueden ser obtenidos a través de los
fermentadores existe un amplio campo de estudio que une los factores asociados
al tipo de proceso biológico y el análisis de las variables que podrán ser
controladas con el equipo.
La
fermentación en estado sólido se aplica de forma masiva a la producción de
hongos, ya sea comestibles o microscópicos, para la obtención de biomasa o
metabolitos secundarios propios del microorganismo, y el análisis de las
tecnologías aplicadas al control de los parámetros de una fermentación
representan un paso fundamental para definir metodologías que garanticen la
calidad y viabilidad de los cultivos.
Los
biorreactores con operación en estado sólido constituyen una alternativa muy
importante para la revalorización de subproductos de industrias alimentarias o
agroindustrias, que son tratados como desechos y en muchos casos implican altos
niveles de polución ambiental, por lo que este tipo de reactor biológico es una
herramienta ecológica para la obtención de productos de interés.
Cabe
resaltar que la utilización de estos equipos conlleva una revisión profunda
acerca del tipo de fermentación y las variables a incluir, esto debido
principalmente a que los factores como flujo de aire y homogeneización del
cultivo son difíciles de manejar; no obstante, considerando las ventajas que
posee el sistema de FES en biorreactores tipo Koji, éste constituye una
herramienta potencialmente muy útil, y es de gran relevancia continuar con el
desarrollo de diseños optimizados paralelamente con el análisis de los
fenómenos de transporte que involucran la fermentación, para llegar a cubrir la
demanda de control de todos los parámetros relacionados.
Agradecimientos
Queremos
agradecer principalmente a la Dra. Andrea Arrúa por su constante guía para la
realización de este proyecto, así como al Centro Multidisciplinario de
Investigaciones. Tecnológicas (CEMIT) por brindarnos las puertas abiertas
cuando lo necesitamos. Al Dr. Gilberto Benítez, a los Lic. José Escurra y Lic.
Shaun McGahan por su predisposición de siempre a ayudarnos, a los Lic. Gustavo
Domínguez, Lic. Leticia Casco y colaboradores que nos dieron la oportunidad de
optimizar su biorreactor, a todo el Departamento de Biotecnología por el apoyo
durante las tardes de trabajo en la facultad.
Fuente
de Financiamiento
Sin
financiamiento externo.
Contribución
de autores
Concepción del estudio: R.N.C.C., L.D.S.D., A.T.R. Diseño del experimento: R.N.C.C., L.D.S.D., A.T.R. Ejecución
del experimento: R.N.C.C.,
L.D.S.D., A.T.R. Verificación
del experimento:. R.N.C.C.,
L.D.S.D., A.T.R. Análisis/interpretación
de datos: R.N.C.C.,
L.D.S.D., A.T.R. Análisis
estadísticos: Preparación del manuscrito: R.N.C.C., L.D.S.D., A.T.R. Edición y revisión del manuscrito: R.N.C.C., L.D.S.D., A.T.R. Aprobación de la versión final del
manuscrito: R.N.C.C.,
L.D.S.D., A.T.R.
Referencias
Bibliográficas
Amaro,
J., Romero-Arenas, O., Rivera, T. & Huerta, L. (2015). Producción de Trichoderma
viride en diferentes sustratos agrícolas. Congreso Latinoamericano de
Agroecología. La Plata, Argentina.
Allori Stazzonelli, E., Yasem de
Romero, M.G. y Ploper, L.D. (2017). Evaluación de sustratos para la producción
de esporas de Trichoderma y estudio del crecimiento en arroz de las
cepas antagonistas TPT03, TPT02, MRT35 y MRT40. Revista agronómica del
noroeste argentino, 37(1), 57-66.
http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S2314-369X2017000100006&lng=es&tlng=es
Chávez-García,
M., Montaña-Lara, J., Martínez-Salgado, M., Mercado-Reyes, M., Rodríguez, M., y
Quevedo-Hidalgo, B. (2008). Efecto del sustrato y la exposición a la luz en la
producción de una cepa de Trichoderma sp. Universitas Scientiarum,
13(3), 245-251.
http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0122-74832008000300003&lng=en&tlng=es.
Costa, M., Torres M. y Reyes, A.
(2012). Caracterización de enzimas hidrolíticas de Aspergillus ficuum
producidas en fermentación sólida. Revista Colombiana de Biotecnología,
14(1), 208-215
http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0123-34752012000100019&lng=en&tlng=es.
Durand,
A. (2003). Diseños de biorreactores para fermentación en estado sólido. Revista
de ingeniería bioquímica, 13 (2-3), 113–125.
doi:10.1016/s1369-703x(02)00124-9 .
González,
A., Mas, S., Cabeza, D. y Campos, M. (2000). Influencia de la luz solar en el
crecimiento y esporulación del biofungicida Trichoderma viride. Tecnología química, 20(1): 92-98.
Manan, M. & Webb, C.
(2020). Newly designed multi-stacked circular tray solid-state bioreactor:
analysis of a distributed parameter gas balance during solid-state fermentation
with influence of variable initial moisture content arrangements. Bioresources and Bioprocessing, 7(16).
https://doi.org/10.1186/s40643-020-00307-9.
Marín
Cárdenas, A., García Rodríguez, A., Herrera Coello, N., y Gómez Rodríguez, L.
(2008). Estudio del proceso de fermentación de la tecnología simplificada de
producción de biomasa proteica por escalado inverso del biorreactor de una
planta industrial. Revista Centro Azúcar, 35(1).
http://centroazucar.uclv.edu.cu/index.php/centro_azucar/article/view/489.
Moreno,
E. y Vanegas, D. (2017). Diseño y construcción de un biorreactor esterilizable
y de bajo costo para el estudio de crecimiento de microorganismos (Tesis de
grado). Universidad Distrital Francisco José de Caldas]. Repositorio
Institucional de la Universidad Francisco José de Caldas RIUD
https://repository.udistrital.edu.co/handle/11349/12989.
Palacios-Rojas,
N. (2018). Calidad nutricional e industrial de Maíz: Laboratorio de Calidad
Nutricional de Maíz “Evangelina Villegas” CDMX, México. CIMMYT
https://repository.cimmyt.org/handle/10883/19667.
Pineda-Insuasti,
J. A., Benavides-Sotelo, E. N., Duarte-Trujillo, A. S., Burgos-Rada, C. A.,
Soto-Arroyave, C. P., Pineda-Soto, C. A., Fierro-Ramos, F. J., Mora-Muñoz, E.
S., y Álvarez-Ramos, S. E. (2017). Producción de biopreparados de Trichoderma
spp: una revisión. ICIDCA. Sobre los Derivados de la Caña de Azúcar,
51(1), 47-52 https://www.redalyc.org/pdf/2231/223153894008.pdf.
Robinson,
T. y Nigam, P. (2003). Bioreactor design for protein enrichment of agricultural
residues by solid state fermentation. Biochemical Engineering Journal, 13,
197-203. doi:10.1016/S1369-703X(02)00132-8.
Robinson,
T., Singh, D., y Nigam, P. (2002).
Fermentación en estado sólido: Una tecnología microbiana promisoria para la
producción de metabolitos secundarios. Vitae, 9(2),27-36
https://www.redalyc.org/articulo.oa?id=169818107003.
Rodríguez
Pérez, S., Crescencia Arone, M. A., Soria Calzadillo, J., Aguilera Rodríguez,
I. A. y Serrat Díaz, M.J. (2017). Determinación de biomasa fúngica y su
utilidad en procesos biotecnológicos”. Afinidad. Revista de Ingeniería
Química teórica y aplicada, 74(577)
https://raco.cat/index.php/afinidad/article/view/320783.
Ruíz-Leza,
H. A., Rodríguez-Jasso, R. M., Rodríguez-Herrera, R., Contreras-Esquivel, J. C.
y Aguilar, C. N. (2007). Diseño de biorreactores para fermentación en medio
sólido. Revista Mexicana de Ingeniería Química, 6(1), 33-40.
Sandoval Vega, M. C. y
Noelting Zenobio, M. C. (2011). Producción de conidios de Trichoderma harzanium
rifai en dos medios de multiplicación. Fitosanidad, 15(4),215-221.
https://www.redalyc.org/articulo.oa?id=2091236p82003.
Silva, J., Santos, N.,
Halfeld-Viera, B.., Nechet, K. y Morandi, M. (2013). Determinación de la
temperatura y fotoperiodo ideales para el crecimiento y esporulación de Trichoderma
en medio líquido. Congreso Interinstitucional de Iniciación Científica
Nº 13422
https://ainfo.cnptia.embrapa.br/digital/bitstream/item/90709/1/2013AA40.pdf
Soccol
C., Scopel E., Junior L., Grace S., Lorenci, A. y Porto de Souza, L. (2017). Recent developments
and innovations in solid-state fermentation. Biotechnology Research and
Innovation, 1(1), 52-71 https://doi.org/10.1016/j.biori.2017.01.002.
Vandenberghe,
L. P. S., Pandey, A. y Carvalho, J. C. (2021). Solid-state fermentation
technology and innovation for the production of agricultural and animal feed
bioproducts. Systems Microbiology and Biomanufacturing, 1, 142–165. doi:10.1007/s43393-020-00015-7.
Vásquez
J. A. (2010). Caracterización
microbiológica y producción de Trichoderma harzianum y Trichoderma
viride en cultivo artesanal. (Tesis de grado, Pontificia Universidad
Javeriana). Repositorio Institucional de la Pontificia Universidad Javeriana.
https://repository.javeriana.edu.co/bitstream/handle/10554/8662/tesis615.pdf?sequence=1&isAllowed=y
![]() , Universidad
Nacional de Asunción.
, Universidad
Nacional de Asunción. ![]()
![]() *,
Laura Denisse Santander Díaz1
*,
Laura Denisse Santander Díaz1![]() ,
Abdón Troche Rotela2
,
Abdón Troche Rotela2![]()







