Introducción
La
salinidad del suelo es un problema mundial cada vez más grave, ya que la sal
dificulta el crecimiento y desarrollo de las plantas y reduce el rendimiento de
los cultivos (Lamz Piedra y González Cepero, 2013; Casierra-Posada et al.,
2013). Además de la salinidad natural del suelo, ésta aumenta como resultado de
las prácticas de riego y el cambio climático (Van Zelm et al., 2020; Zhu, 2001;
Parihar et al., 2014). La mayoría de las especies cultivadas son sensibles a la
salinidad en todas las etapas del desarrollo de la planta, siendo la
germinación y el crecimiento temprano de las plántulas las más vulnerables
(Liedl et al., 2013; Yurtseven et al., 2005; Hajiboland et al., 2010); debido a
que se absorben iones potencialmente tóxicos, lo cual genera la disminución en
la asimilación del agua, ocasionando que el proceso germinativo se retrase
(Kaveh et al. 2011). A nivel de raíces, éstas alcanzan una menor longitud de
modo que el volumen de suelo que pueden explorar es menor (Goykovic Cortés y
Saavedra del Real, 2007). De acuerdo con cada fase de crecimiento y variedad de
tomate la sensibilidad de la salinidad varía (Aini et al., 2012).
En
la mayoría de los genotipos de tomate se presenta una reducción de la
germinación y el crecimiento debido al estrés salino, sin embargo, algunos
genotipos silvestres se desarrollan bien en esta condición (Tahir et al.,
2018). Las sales en el exterior de las raíces tienen un efecto inmediato sobre
el crecimiento celular y el metabolismo asociado (Munns y Tester, 2008); las
plantas en general sufren estrés osmótico debido a las sales acumuladas en el
exterior de las raíces y estrés iónico en el interior de las células de la
planta (Horie et al., 2012).
Debido
a que el NaCl es la sal más soluble y presente en los suelos, no es
sorprendente que todas las plantas hayan evolucionado y desarrollado mecanismos
como el ajuste osmótico y la homeostasis iónica para regular su acumulación a
favor de otros minerales comúnmente presentes en bajas concentraciones, como K+
y NO3- (Lamz Piedra y González Cepero, 2013). En la mayoría de las
plantas, las raíces son capaces de excluir eficazmente los iones Na+
y Cl- del agua absorbida del suelo (Munns, 2005).
Se
han detectado varias especies del género Solanum con tolerancia a salinidad,
incluyendo a Solanum lycopersicum L., lo que demuestra que es posible
detectar germoplasma de interés en la especie cultivada. Se han identificado
recursos genéticos tolerantes a salinidad en especies de tomate silvestres (Solanum
chilense, S. peruvianum, S. pennellii, S. cheesmanii y
S. pimpinellifolium) y en cultivares de S. lycopersicum (Foolad
et al., 1999; Liedl et al., 2013). Estos resultados dan cuenta de la existencia
de variabilidad genética en tomate y por tanto de la existencia de germoplasma
que podría ser importante para el mejoramiento genético de tolerancia a estrés
salino, especialmente en aquellas especies silvestres que presenten
compatibilidad genética con los cultivares comerciales, como S.
pimpinellifolium y S. pennellii (Goykovic Cortés y Saavedra del
Real, 2007). Es por ello por lo que las especies silvestres son una fuente
importante de genes de interés agronómico, como resistencia a factores bióticos
y abióticos, base para el mejoramiento genético de la especie cultivada
(Flores-Hernández et al., 2017). El aumento de la tolerancia a estrés salino
requiere nuevas fuentes genéticas de esta tolerancia y técnicas más eficientes
para identificar el germoplasma tolerante (Munns, 2005). El objetivo de esta
investigación es el de identificar plantas tolerantes a salinidad a partir de
colectas de tomate silvestres, con la finalidad de poder utilizar estas líneas
en programas de mejoramiento genético.
Materiales y Métodos
La
investigación se realizó en las instalaciones de la Universidad Autónoma
Chapingo (UACh), México (19°29'LN, 98°53'LO y 2240 msnm). Las pruebas de
tolerancia a salinidad durante la germinación se realizaron en el laboratorio
de semillas del Departamento de Fitotecnia, mientras que las pruebas de
tolerancia a salinidad en plántula se llevaron a cabo en el invernadero del
Programa de Mejoramiento Genético de Tomate, durante 2018 y 2019.
Material vegetal
Para
la obtención de líneas y material vegetal (semillas), durante 2017 se llevó a
cabo un ciclo de cultivo de 120 colectas de material silvestre, 55 provienen de
la colección de semillas que tiene el programa de mejoramiento genético de
tomate del Instituto de Horticultura de la UACh y 65 provienen de la colección
del Dr. Ricardo Lobato Ortiz del Colegio de Posgraduados, las cuales fueron
cultivadas en un invernadero tipo “full vent” de nivel tecnológico
medio, con cubierta de polietileno calibre 600 con transmisión de luz de 70 %,
y ventilación frontal, lateral y superior protegida por malla antiáfidos,
ubicado en la UACh (19°29'LN 98°53'LO; 2240 msnm); con temperatura media anual
de 15,9 °C.
Pruebas de tolerancia a la salinidad durante la
germinación
Para los tratamientos con sales en germinación se
seleccionaron 96 líneas (Tabla 1).
Tabla 1. Líneas de
tomate silvestres utilizadas en pruebas de tolerancia a salinidad en etapa de
germinación. Todas pertenecientes a Solanum lycopersicum
L., originarias de distintos estados de México, el origen de cada línea se
refiere al indicador dado a las líneas madre en las colecciones de donde
proceden.
|
Línea
|
Origen
|
|
Línea
|
Origen
|
|
Línea
|
Origen
|
|
1
|
Cereza 4
sin acido
|
|
24
|
LOR 85
|
|
51
|
LOR 113
|
|
|
2
|
Totonaca
2(2016)
|
|
25
|
LOR 86
|
|
53
|
LOR 115
|
|
|
6
|
Arriñonado
6 sin acido
|
|
26
|
LOR 87
|
|
54
|
LOR 116
|
|
|
7
|
Silvestre
Pancho (2016)
|
|
27
|
LOR 88
|
|
56
|
LOR 118
|
|
|
8
|
Claudia
2017
|
|
31
|
LOR 92
|
|
57
|
LOR 119
|
|
|
10
|
Huasave,
Dr. Mascorro
|
|
32
|
LOR 93
|
|
58
|
LOR 120
|
|
|
11
|
TomatilloMpio.
Tecpan de Galiana
|
|
33
|
LOR 94
|
|
59
|
LOR 121
|
|
|
12
|
Ixhuatlan
de Madero, Veracruz (2016)
|
|
35
|
LOR 97
|
|
60
|
LOR 122
|
|
|
13
|
Silvestre
Oaxaca, Mercado (2016)
|
|
36
|
LOR 98
|
|
61
|
LOR 123
|
|
|
15
|
Arriñonado
Chignahuapan, Puebla
|
|
38
|
LOR 100
|
|
62
|
LOR 124
|
|
|
16
|
LOR 77
|
|
39
|
LOR 101
|
|
64
|
LOR 128
|
|
|
17
|
LOR 78
|
|
40
|
LOR 102
|
|
65
|
LOR 129
|
|
|
18
|
LOR 79
|
|
41
|
LOR 103
|
|
66
|
LOR 130
|
|
|
19
|
LOR 80
|
|
42
|
LOR 104
|
|
67
|
LOR 131
|
|
|
21
|
LOR 82
|
|
46
|
LOR 108
|
|
68
|
LOR 132
|
|
|
22
|
LOR 83
|
|
50
|
LOR 112
|
|
69
|
LOR 133
|
|
|
|
|
|
|
|
|
(Cont.
Tabla 1)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Línea
|
Origen
|
|
Línea
|
Origen
|
|
Línea
|
Origen
|
|
(Cont.
Tabla 1)
|
|
|
|
|
|
|
|
70
|
LOR
134
|
|
96
|
J106
|
|
113
|
CM-37
|
|
71
|
LOR
135
|
|
97
|
CM-46
|
|
114
|
C1-47
|
|
72
|
LOR
136
|
|
98
|
CM-35
|
|
115
|
CM-19
|
|
74
|
LOR
137
|
|
99
|
CM-45
|
|
116
|
C1-89
|
|
75
|
LOR
140
|
|
101
|
CM-31
|
|
117
|
CM-4
|
|
76
|
LOR
141
|
|
102
|
C2-G5
|
|
118
|
CM-83
|
|
77
|
LOR
142
|
|
103
|
CM-16
|
|
119
|
C1-43
|
|
79
|
LOR
144
|
|
104
|
CM-44
|
|
120
|
C2-1
|
|
80
|
LOR
145
|
|
105
|
C1-G80
|
|
|
|
|
81
|
LOR
149
|
|
106
|
CM-21
|
|
|
|
|
82
|
LOR
146
|
|
107
|
CM-34
|
|
|
|
|
83
|
LOR
147
|
|
108
|
C1-G20
|
|
|
|
|
84
|
LOR
148
|
|
109
|
C1-32
|
|
|
|
|
85
|
Chichón
|
|
110
|
CM-23
|
|
|
|
|
86
|
CM-1
|
|
111
|
CM-29
|
|
|
|
|
87
|
CM-5
|
|
112
|
CM-49
|
|
|
|
|
|
|
|
|
|
|
|
|
Para
determinar la tolerancia de las líneas de tomates silvestres se realizó una
prueba de germinación durante 20 días en una cámara de germinación con
oscuridad constante y temperatura de 27±1°C, donde fueron sembradas
25 semillas por línea en cajas Petri de 6 cm de diámetro, sobre papel filtro
como sustrato, probando las semillas en condiciones salinas a una concentración
de 150 mM de NaCl y sin sal, para ello el sustrato se saturó con 2 ml de agua
destilada (0 mM) o con la solución salina a 150 mM. Se usó un diseño
completamente al azar con tres repeticiones.
Se
realizaron conteos diarios de semillas germinadas, considerando una semilla
germinada cuando se presentó la protrusión de la radícula. Se evaluó el
porcentaje de germinación (PG), porcentaje de plántulas normales (PN),
considerando plántulas normales aquella con cambios graduales y progresivos en
tamaño y estructura optimas mediante clasificación visual para diferenciar
entre plantas normales y aquellas que presentan algún daño (Figura 1) e índice
de velocidad de germinación (IVG) de acuerdo a la fórmula de Maguire (1962):
 i=
1,2, 3, …, n.
i=
1,2, 3, …, n.
Donde
n= número de conteos realizados durante la prueba;
Xi= número de semillas germinadas entre el conteo i-1 y el
conteo i; di= número de días después de la siembra en el
conteo i.
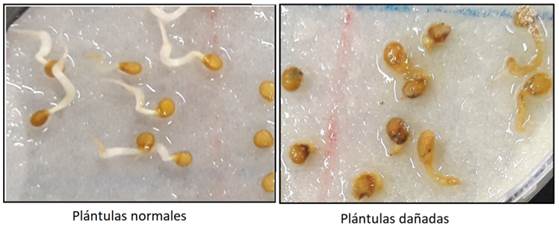
Figura 1. Clasificación de plántulas normales y plántulas dañadas.
Pruebas de sales en plántula
Para las
evaluaciones en plántula se seleccionaron 41 líneas (Tabla 2) y como testigo al
híbrido comercial Cuauhtémoc:
Tabla 2. Líneas de tomate silvestre utilizadas en pruebas de
tolerancia a salinidad en etapa de plántula.
|
Línea
|
Origen
|
|
Línea
|
Origen
|
|
2
|
Totonaca
2(2016)
|
|
84
|
LOR
148
|
|
6
|
Arriñonado
6 sin acido
|
|
85
|
Chichón
|
|
10
|
Huasave,
Dr. Mascorro
|
|
87
|
CM-5
|
|
11
|
Tomatillo
Mpio. Tecpan de Galiana
|
|
88
|
CM-11
|
|
16
|
LOR
77
|
|
90
|
CM-30
|
|
17
|
LOR
78
|
|
91
|
CM-39
|
|
19
|
LOR
80
|
|
92
|
CJ46
|
|
27
|
LOR
88
|
|
95
|
CM59
|
|
55
|
LOR
117
|
|
96
|
J106
|
|
56
|
LOR
118
|
|
102
|
C2-G5
|
|
58
|
LOR
120
|
|
107
|
CM-34
|
|
60
|
LOR
122
|
|
109
|
C1-32
|
|
61
|
LOR
123
|
|
110
|
CM-23
|
|
62
|
LOR
124
|
|
111
|
CM-29
|
|
68
|
LOR
132
|
|
113
|
CM-37
|
|
72
|
LOR
136
|
|
114
|
C1-47
|
|
74
|
LOR
137
|
|
117
|
CM-4
|
|
75
|
LOR
140
|
|
118
|
CM-83
|
|
79
|
LOR
144
|
|
119
|
C1-43
|
|
81
|
LOR
149
|
|
121
|
L3
|
|
82
|
LOR
146
|
|
122
|
Cuauhtémoc
|
|
|
|
|
|
|
Las
semillas fueron sembradas en semilleros de germinación de polipropileno de 200
cavidades con sustrato de turba. En los primeros 10 días después de la siembra
(dds) se regaron con agua destilada. Entre 10 y 20 dds se utilizó solución
nutritiva de Steiner (1961) con concentración de 50%. A partir de los 21 dds se
iniciaron los tratamientos con soluciones salinas mediante inmersión diaria en
solución nutritiva de Steiner al 100% adicionada con 8,76 g de NaCl por litro
para tener una concentración de 150 mM de NaCl. En las plantas control sin
aplicación de NaCl se utilizó solución nutritiva al 100%. Los tratamientos se
mantuvieron durante 45 días hasta finalizar la prueba.
La unidad experimental consistió en 10 plántulas, el
diseño experimental empleado fue de bloques completos al azar con 4
repeticiones. A los 45 días después de la siembra se evaluaron el Contenido
Relativo de Agua (CRA) obtenido con la formula.
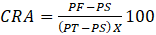 ,
,
donde
PF = peso fresco (obtenido pesando una muestra de 1
cm2 de hoja recién colectada), PT = peso turgente (obtenido
después de depositar las muestras de hoja en agua destilada durante 24 horas
para que estuvieran turgentes y posteriormente pesadas) y PS = peso seco
(obtenido después de que las muestras se secaron en una estufa durante 5 días a
una temperatura de 70°C hasta peso constante).
Además se evaluó el peso fresco total (PFT) en mg,
obtenido pesando la plántula completa; el peso de raíz (PR) en mg,
obtenido separando la porción de raíz y pesando en fresco; peso seco (PS)
en mg, obtenido después de secar la parte aérea de la plántula durante 5 días
en una estufa a una temperatura de 70 °C; peso seco de raíz (PSR) en mg
se obtuvo después de secar la raíz de la plántula en una estufa a 70°C durante
5 días; altura de planta (AP) en cm, se obtuvo midiendo la longitud de
la plántula desde el inicio del tallo hasta el ápice y longitud de raíz (LR)
en cm.
Análisis
estadístico
Para el análisis estadístico se calcularon índices de
tolerancia a sales a partir de los cocientes de los promedios de la variable
obtenida en condición salina entre el promedio de la variable correspondiente
la condición sin estrés. Con estos índices se realizó un análisis multivariado
de agrupamiento a partir de la matriz de distancias euclidianas cuadradas. El
dendrograma se construyó con el algoritmo de mínima varianza de Ward. La altura
de corte con base en el criterio cubico de agrupamiento (Statistical Analysis
System [SAS], 1983) y la pseudo estadística t2 (Hotelling, 1951).
El método de agrupamiento (mínima varianza de Ward) es el
utilizado tanto por Marín-Montes et al. (2016) y Magallanes-López et al.
(2020), ya que como indican Núñez-Colín y Escobedo-López (2011) este método es
más recomendable cuando el objetivo del trabajo es conocer la variabilidad o
diversidad existente en genotipos de una especie o género especifico.
Se
realizó un análisis discriminante canónico a las agrupaciones que se generaron
en el análisis de agrupamiento, tomando como variable clasificatoria estos mis
mismos grupos que se obtuvieron en el análisis anterior. Por último, se
realizaron análisis de varianza y comparaciones de medias de Tukey con α= 0.05
para describir los grupos de colectas que se identificaron.
Resultados
Análisis de agrupamiento para tolerancia a sal durante
germinación
El dendrograma obtenido con el algoritmo de varianza
mínima de Ward (Figura 2) permitió identificar 5 grupos, que fueron definidos a
partir del criterio cúbico de agrupamiento y de la pseudo t2, con
una altura de corte de 0.06 r2 semiparcial. Las diferencias en
tolerancia a sales durante la germinación permitieron agrupar líneas con
comportamiento similar dentro de grupos, pero con tolerancia diferente entre
grupos. El grupo 1 quedó constituido por 17 líneas, el grupo 2 por 35, el 3 por
25, el 4 por 11 y el 5 por 8 líneas cada uno.
Análisis
discriminante para la tolerancia a la salinidad durante la germinación
En el análisis discriminante se utilizó como variable
categórica a los cinco grupos identificados en el análisis de agrupamiento, se
generaron dos funciones discriminantes Variable discriminante 1 (VD1) y
Variable discriminante 2 (VD2), que explicaron el 99% de la variabilidad total
de los datos, con 84% y 15% respectivamente. La VD1 se asoció de manera
positiva con el porcentaje de PN y PG en condiciones de estrés salino, mientras
que la VD2 se asoció de manera positiva con el IVG, lo que indica que los
valores altos de VD1 y VD2 corresponden a una mayor tolerancia al estrés por
sales.
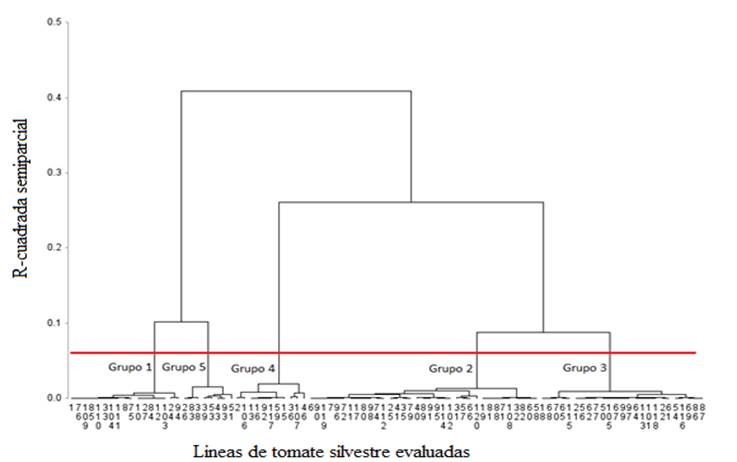
Figura 2. Dendrograma jerárquico
(distancias euclidianas cuadradas y método de mínima varianza Ward) de 96
líneas de tomate silvestre evaluadas en germinación bajo condiciones salinas.
La
Figura 3 muestra la representación gráfica de VD1 y VD2 de cada línea evaluada,
se observa que el grupo 4 con 11 líneas, tiene un mayor porcentaje de
geminación y de plantas normales, lo que lo identifica como el grupo que
presenta una mayor tolerancia al estrés salino, el grupo 5 muestra valores
elevados en IVG, sin embargo, su PG y PN fueron bajos.
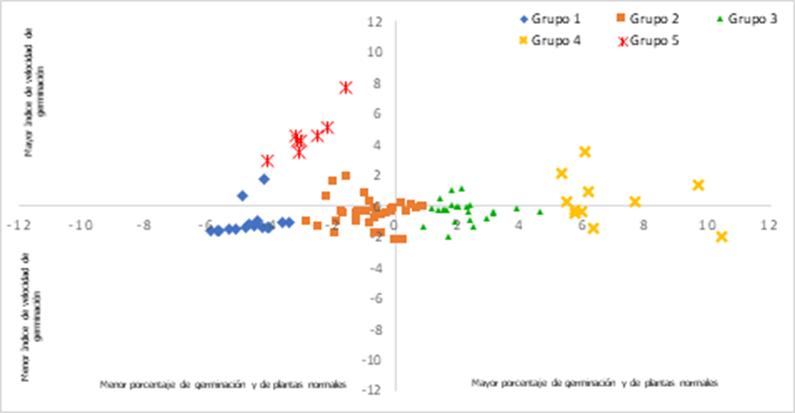
Figura 3. Representación gráfica
de agrupación por variables discriminantes de 96 líneas de tomate silvestre
evaluadas en germinación bajo condiciones salinas.
Los
grupos 2 y 3 mostraron niveles intermedios para cada una de las variables
evaluadas, mientras que el grupo 1, con 35 líneas, fue el que mostró un mayor
efecto negativo al ser evaluado en condiciones salinas (Figura 3).
Análisis
de varianza para la tolerancia a la salinidad durante la germinación
El análisis de varianza (Tabla 3) mostró diferencias
significativas entre grupos, líneas dentro de grupos, concentraciones,
interacción de grupo por concentración para cada una de las variables
evaluadas; en la interacción de líneas dentro de grupo por la concentración de
sales, se encontraron diferencias altamente significativas en el porcentaje de
plántulas normales y en el IVG.
Los
coeficientes de variación obtenidos estuvieron entre 36 y 46% en las variables
evaluadas, lo que se considera como valores altos, debido principalmente al
estrés al que fueron sometidas las plantas al estar en condiciones salinas,
además de la variabilidad genotípica de las líneas.
Tabla 3. Análisis de varianza
de caracteres evaluados en 96 líneas de tomate en germinación bajo condiciones
salinas.
|
FV
|
PG
|
PN
|
IVG
|
|
Grupo
|
**
|
**
|
**
|
|
GEN(GRU)
|
**
|
**
|
**
|
|
CON
|
**
|
**
|
**
|
|
GRU*CON
|
**
|
**
|
**
|
|
CON*GEN(GRU)
|
ns
|
**
|
**
|
|
BLO
|
**
|
**
|
**
|
|
CV
|
39,69
|
46,06
|
36,27
|
|
MEDIAS
|
40,30
|
30,91
|
2,64
|
FV= Fuentes de variación; PG= Porcentaje de germinación; PN=
Porcentaje de plántulas normales; IVG= Índice de Velocidad de Germinación; GRU=
Grupo; GEN(GRU)= línea; CON=Concentración; GRU*CON= Interacción grupo x
concentración; CON*GEN(GRU)= Interacción de concentración x línea; BLO= bloque;
CV= Coeficiente de Variación; ** Significativo con α≤ 0.01
En
las comparaciones de medias para las concentraciones salinas de 0 mM de NaCl y
150 mM de NaCl se observa el efecto que tiene el estrés salino sobre las líneas
evaluadas, en cada una de las variables se encontraron diferencias
significativas; hubo una reducción considerable en el porcentaje de
germinación, el de plantas normales y el IVG, siendo este último el que resultó
más afectado ya que se redujo en un 81% (Tabla 3).
Las
comparaciones de medias para grupo por concentración (Figura 4) nos indican
que el grupo 1 abarca líneas que muestran valores altos para PG, PN e IVG al
no estar sometidas a estrés salino sin embargo es el que más resiente la
aplicación de NaCl, ya que estos valores se reducen entre 83 y 94% por tanto es
el más susceptible coincidiendo con lo observado en el análisis discriminante;
el grupo 5 presenta valores bajos para cada una de las variables evaluadas en
ambas condiciones, este grupo incluye las 8 líneas menos tolerantes tanto por
susceptibilidad al estrés salino, como por su desempeño en condiciones sin
estrés; los grupos 2 y 3 mostraron una reducción considerable en cada una de
las variable evaluadas al estar sometidos a condiciones de estrés por sales; el
grupo 4 es el que muestra una menor reducción en su PG (1,15%) al pasar a una
condición salina, mientras que el PN incluso se incrementa al estar en una
concentración de 150 mM de NaCl (de 24,97 a 33,09 %) aunque su IVG se ve
disminuida, este grupo incluye a las 11 líneas que muestran una mayor
tolerancia a estrés por sales.

Figura 4. Comparación de medias
para grupo por concentración de caracteres evaluados en 96 líneas de tomate en
germinación.En
grupos: a= sin aplicación de NaCl; b= concentración a 150 mM de NaCl; Medias
con la misma letra dentro de columnas no difieren estadísticamente (Tukey, α= 0,05).
Tolerancia
a la salinidad en plántulas
Análisis de agrupamiento para la tolerancia a salinidad en
plántulas
Las 41 líneas evaluadas mostraron diversos niveles de
tolerancia a sales en germinación y como testigo a la variedad Cuauhtémoc. El
análisis de agrupamiento permitió determinar 4 grupos con una r2
semiparcial de 0,04.
El
grupo 1 estuvo compuesto por 10 líneas, el grupo 2 por 13 líneas y el testigo,
el grupo 3 por 12 y el 4 por 6 líneas respectivamente (Figura 5).
Análisis discriminante para la tolerancia a la salinidad
en plántulas
El análisis
discriminante canónico (Figura 6) mostró que las variables discriminantes VD1 y
VD2 explicaron el 94 % de la variación total, la VD1 con 80 % se asoció
positivamente con el PR y con el PSR, mientras que la VD2 con 14 % se asoció
positivamente con la AP y con el PS. Esto indica que aquellas líneas con
valores altos de VD1 y VD2 son las que tienen un grado mayor de tolerancia a
estrés salino en etapa de plántula. Al respecto Morales et al. (2010) menciona
que una de las partes más afectadas de la planta al ser sometida a estrés
salino son las raíces y el daño es mayor conforme aumenta la concentración de
sales; por lo tanto, un indicador de tolerancia sería una mayor cantidad de
raíces.
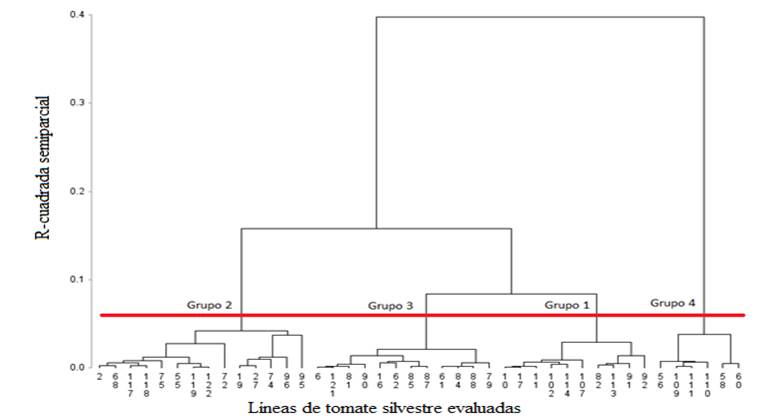
Figura 5. Dendrograma jerárquico de 41 líneas de tomate silvestre y un
testigo, evaluadas en plántula bajo condiciones salinas, derivado de distancias
euclidianas cuadradas y algoritmo de mínima varianza de Ward.
El grupo 4, con 6 líneas, fue el que presentó valores más
altos para PR, PSR, AP y PS, por lo que es el que mostró un mayor nivel de tolerancia
a salinidad; el grupo 2 tuvo valores altos en AP y PS, pero los valores de PR y
PSR fueron bajos, lo que caracteriza a estas líneas entonces es que tienen una
parte aérea mayor que la raíz; los grupos 1 y 3 mostraron valores medios en los
caracteres evaluados.
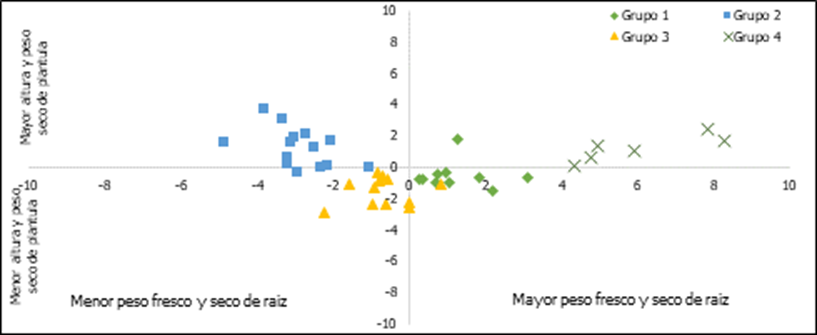
Figura 6. Variables
discriminantes de 41 líneas de tomate silvestre y un testigo, evaluadas en
plántula bajo condiciones salinas
Análisis
de varianza para la tolerancia a la salinidad en plántulas
El análisis de
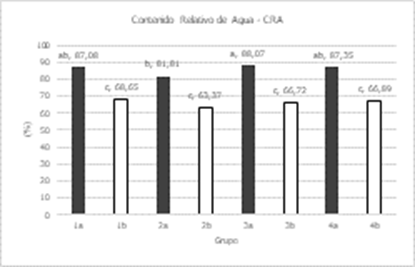
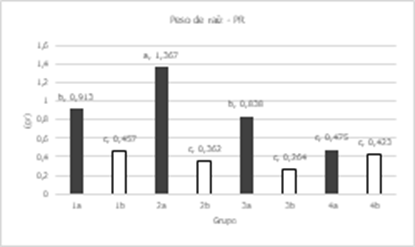
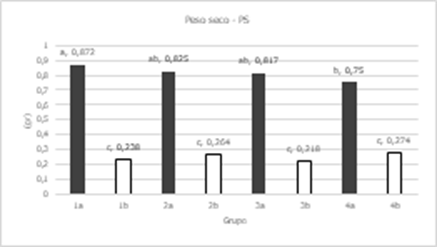
varianza (Tabla 4) mostró diferencias significativas entre grupos para CRA, PR,
PSR y AP; entre líneas se encontraron diferencias significativas en todas las
variables a excepción de CRA; entre concentraciones todas las variables fueron
diferentes significativamente, menos LR; en la interacción de grupo por
concentración sólo el CRA no tuvo diferencias significativas; mientras que en
concentración por línea el PF, PS, PSR y AP tuvieron diferencias
significativas. Los coeficientes de variación fueron relativamente bajos en
CRA, PF, PS, AP, y LR ya que estuvieron entre 9 y 22%; mientras que en PSR y PR
tuvieron 30 y 50 % respectivamente.
Tabla 4. Análisis de varianza de caracteres evaluados en 41 líneas y
testigo de tomate en plántula.
|
Fuente
|
CRA
|
PF
|
PR
|
PS
|
PSR
|
AP
|
LR
|
|
GRU
|
**
|
ns
|
**
|
ns
|
**
|
**
|
ns
|
|
LIN(GRU)
|
ns
|
**
|
**
|
**
|
**
|
**
|
*
|
|
CON
|
**
|
**
|
**
|
**
|
**
|
**
|
ns
|
|
GRU*CON
|
ns
|
*
|
**
|
**
|
**
|
**
|
**
|
|
CON*LIN
(GRU)
|
ns
|
**
|
ns
|
**
|
*
|
**
|
ns
|
|
CV
|
9,39
|
22,13
|
50,129
|
20,125
|
30,76717
|
9,49
|
14,10
|
|
MEDIAS
|
73,91
|
3,60
|
0,611
|
0,477
|
0,09175
|
25,89
|
7,77
|
FV=Fuentes de variación; CRA= Contenido
Relativo de Agua, PF= peso fresco; PR= peso de raíz; PS= peso seco; PSR= Peso
seco de raíz; AP= Altura de plántula; LR= Longitud de raíz; GRU= Grupo;
LIN(GRU)= Línea; CON= Concentración; GRU*CON= Interacción de grupo por
concentración; CON*LIN(GRU)= Interacción de concentración por línea; CV=
Coeficiente de Variación; ** Significativo con α≤ 0.01
Las comparaciones de medias para concentraciones mostraron
una disminución en las variables evaluadas cuando fueron sometidas a estrés por
sales, a excepción de LR que mostro un ligero incremento cuando las plántulas
estuvieron bajo condiciones salinas; las variables más afectadas fueron PF, PR,
PS y PSR que disminuyeron entre un 60 y 70 %.
En las comparaciones de medias para grupo por
concentración (Figura 7) se puede observar que los grupos presentaron valores
más bajos en las variables CRA, PF, PR, PS, PSR y AP cuando estuvieron en una
concentración de 150 mM de
NaCl, lo que indica que se vieron afectadas por el estrés al que fueron
sometidas.
La altura de planta (AP) en cada grupo se vio afectada por
la concentración de sales, provocando una reducción en la misma de entre 32 y
56%, el grupo menos afectado fue el grupo 2.
El CRA también se vio
reducido en cada grupo, aunque este afecto de manera similar, con reducciones
de entre 21 y 24 %. La Longitud de la raíz fue la variable menos afectada, el
grupo 3 presento una disminución de 10 %, mientras que los grupos 1 y 2
presentaron mayores valores en presencia de sales
Figura 7. Comparación de medias para Grupos en etapa de plántula en
caracteres evaluados en 41 líneas de tomate y un testigo. En grupos: a= sin aplicación de NaCl; b= aplicación de NaCl
a una concentración a 150 mM; Medias con la misma letra no difieren
estadísticamente (Tukey, α= 0,05).
Discusión
Los resultados obtenidos en el análisis discriminante para
la tolerancia a la salinidad en germinación concuerdan con Cortés et al.
(2014) quienes encontraron que los genotipos con mayor tolerancia a sales son
aquellos que tienen porcentajes de germinación más altos y una mayor biomasa.
Igualmente, Estrada-Trejo et al. (2014) mencionan que los genotipos que
presentan un mayor grado de tolerancia a sales son aquellos que tienen
porcentaje y velocidad de germinación más alto al ser sometidos a estrés
salino.
El análisis de varianza para las pruebas de tolerancia a
estrés salino confirma que existen diferencias en el nivel de tolerancia a
sales tanto entre los grupos obtenidos como entre las líneas evaluadas. Tal
como lo mencionan Ruiz-Espinoza et al. (2014) que indican que la salinidad
afecta de forma diferenciada según el cultivar, jugando un papel importante la
variabilidad genética y la etapa del desarrollo de las plantas. De la misma
forma Aini et al. (2017) encontraron que la solución salina influye en la
germinación de semillas dependiendo de la variedad de tomate. A su vez Chakma
et al. (2019) mencionan que los diferentes niveles de las concentraciones de
sal de NaCl influyen significativamente en la germinación de las semillas;
observaron que la germinación de las semillas disminuía al aumentar la
concentración de NaCl, la germinación máxima de semillas (68,25%) la
encontraron en condiciones de control no tratadas (0 mM) seguido de 50 mM (27,08%),
100 mM (9,92%) y la germinación mínima (5,92%) fue con una concentración de sal
150 mM. Kaveh et al. (2011) encontraron una correlación negativa significativa
entre la salinidad y la tasa y el porcentaje de germinación que resultó en una
germinación retrasada y un porcentaje de germinación reducido en Solanum
lycopersicum L.
La condición de estrés por sales afecta cada una de las
variables evaluadas en cada una de las líneas bajo estudio. De manera similar
Devi y Arumugam (2019), mencionan que el porcentaje de germinación del tomate
estuvo muy influenciado por el estrés salino a una concentración más alta (100
mM de NaCl). Coincidiendo con Tahir et al.g (2018) que encontró que el estrés
salino tuvo un efecto adverso sobre la tasa de germinación y el porcentaje de
germinación. Singh et al. (2012) también observaron una reducción en la
velocidad de germinación de tomate al estar sometido a salinidad coincidiendo
con los resultados obtenidos en la presente investigación.
Los resultados de las pruebas de tolerancia a salinidad en
plántula concuerdan con lo reportado por Devi y Arumugam (2019), ya que
menciona que la longitud de plántula y la longitud de la raíz fueron
significativamente diferente en todos los tratamientos (0 NaCl, 25 mM NaCl,
50mM NaCl y 100mM NaCl). De igual manera Kaveh et al. (2011) encontraron que
las interacciones entre líneas x niveles de salinidad fueron significativas
para el porcentaje de emergencia, la tasa de emergencia y el peso fresco y seco
de la plántula.
Lara et al. (2015) reportan que la altura de planta y la
producción de materia seca disminuyen al incrementar la conductividad, además
que las 48 líneas nativas y de los dos testigos comerciales que evaluaron
fueron afectadas negativamente por el incremento en la conductividad eléctrica.
De forma similar a lo observado en la presente investigación.
En etapa de plántula las variables más afectadas fueron el
PF, PR, PS y PSR ya que tuvieron una disminución de entre 50 y 70 % (Tabla 4);
al respecto Hajiboland et al. (2010) mencionan que a alta salinidad reduce la
producción de materia seca de las plantas en los cultivares que evaluaron,
además que la influencia de la salinidad en las plantas fue altamente
dependiente de los cultivares. De igual manera, Yurtseven et al., (2005)
coinciden en que el rendimiento de la biomasa se ve afectado por la salinidad,
ya que la disminución promedio en el rendimiento de biomasa causada por un
aumento en la salinidad de 2,5 a 5,0 dS m-1 fue del 37%, y cuando la
salinidad aumenta aún más a 10.0 dS m-1 se obtiene una reducción
adicional del rendimiento de aproximadamente el 60%.
Ruiz Espinoza et al. (2014) encontraron que todos los
órganos de la parte aérea de las plantas de tomates se alteraron con la
salinidad. Mientras que Chakma et al. (2019) mencionan que la longitud de la
raíz fue influenciada significativamente por los efectos de diferentes
variedades de tomate, así como por la concentración de sal. De igual forma
Tahir et al. (2018) mencionan que la longitud de la raíz, la longitud del
brote, el peso fresco de la raíz y el peso fresco de 30 genotipos de tomate que
evaluaron, el estrés salino tuvo un efecto adverso; además en todos los
genotipos estudiados observaron una variación significativa en la tolerancia a
la sal.
De
la presente investigación se puede continuar la evaluación de los materiales
ahora en etapa de planta, además de evaluar como responden en rendimiento al
ser sometidas a estrés salino. En cuanto a la parte molecular se puede evaluar
la presencia y expresión de genes que han sido relacionados con la tolerancia a
sales.
Conclusiones
Se
identificó un grupo de 11 líneas (2 ,13, 15, 16, 36, 46, 59, 92, 106, 107, 117)
de tomate con tolerancia a salinidad en germinación y un grupo de 6 líneas (56,
58, 60, 109, 110, 111) con una mayor tolerancia al estrés salino en etapa de
plántula. La tolerancia a la salinidad de las líneas de tomate estudiadas
mostró una respuesta variable en la etapa de germinación y en la plántula.
Estos resultados sugieren que la tolerancia al estrés salino depende de
múltiples factores como el genotipo y el estado de desarrollo.
Contribución
de los autores
Concepción del
estudio:
J.C.V.H., J.O.M.G., J.E.R.P. Diseño del experimento: J.C.V.H., J.O.M.G.,
J.E.R.P. Ejecución
del experimento:
J.C.V.H.. Verificación
del experimento:
J.C.V.H., J.O.M.G., J.E.R.P., J.L.R.O Análisis/interpretación de datos: J.C.V.H., J.E.R.P.,
J.S.C. Análisis
estadísticos:
J.C.V.H., J.E.R.P. , J.S.C. Preparación del manuscrito: J.C.V.H. Edición y revisión
del manuscrito:
J.E.R.P., J.O.M.G., J.L.R.O., J.S.C. Aprobación de la versión final del manuscrito:
J.E.R.P.,
J.O.M.G., J.S.C., J.L.R.O.
Fuente de
Financiamiento.
sin financiamiento externo.
Referencias Bibliográficas
Aini,
N., Dwi Yamika, W. S. & Setiawan, A. (2017). The role of salt (NaCl) stress
on seed germination, growth and proline content of some tomato varieties. Journal
of Applied Horticulture, 19(3), 245-248.
http://www.horticultureresearch.net/
Aini, N., Mapfumo, E.,
Rengel, Z. & Tang, C. (2012). Ecophysiological responses of Melaleuca
species to dual stresses of water logging and salinity. International
Journal of Plant Physiology. Biochemistry, 4(4): 52-58.
doi: 10.5897/IJPPB11.032
Casierra-Posada, F.,
Arias-Aguirre, J. A. & Pachón, C. A.. (2013). Efecto de la salinidad por
NaCl en híbridos de tomate (Lycopersicon esculentum Miller). Orinoquia, 17
(1), 23-29 http://ref.scielo.org/bn7y2y
Chakma, P., Hossain,
M. M. & Rabbani, M. G. (2019). Effects of salinity stress on seed
germination and seedling growth of tomato. Journal of the Bangladesh
Agricultural University, 17(4), 490-499.
https://doi.org/10.3329/jbau.v17i4.44617
Cortés, V. G.,
Alanoca, P. N. & Llave, M. C. (2014). Efecto de la salinidad sobre la
germinación y crecimiento vegetativo de plantas de tomate silvestres y
cultivada. Interciencia, 39(7), 511-517.
https://www.redalyc.org/articulo.oa?id=33931446010
Devi, N. D. &
Arumugam, T. (2019). Screening of tomato genotypes at various
levels of salinity. Journal of Pharmacognosy and Phytochemistry, 8(3),
3199-3201.
http://www.phytojournal.com/archives/2019/vol8issue3/PartAT/8-3-219-706.pdf
Estrada-Trejo, V.,
Lobato-Ortiz, R., García-de los Santos, G., Carrillo-Castañeda, G.,
Castillo-González, F., Contreras-Magaña, E., Ayala-Garay, O. J., De la O Olan,
M. & Artola Mercadal, A. (2014). Diversidad de poblaciones nativas de
jitomate para germinación en condiciones salinas. Revista mexicana de
ciencias agrícolas, 5(6), 1067-1079. doi:10.29312/remexca.v5i6.890
Flores-Hernández, L.
A., Lobato-Ortiz, R., García-Zavala, J. J., Molina-Galán, J. D.,
Sargerman-Jarquín, D. M. & Velasco-Alvarado, M. D. J. (2017). Parientes
silvestres del tomate como fuente de germoplasma para el mejoramiento genético
de la especie. Revista Fitotecnia Mexicana, 40(1),
83-91.https://doi.org/10.35196/rfm.2017.1.83-91
Foolad, M. R, Lin, G.
Y. & Chen, F.Q. (1999).
Comparison
of QTLs for seed germination under nonstress, cold stress and salt stress in
tomato. Plant
Breed 118(2),
167–173. https://doi.org/10.1046/j.1439-0523.1999.118002167.
Goykovic Cortés, V.
& Saavedra del Real, G. (2007). Algunos efectos de la salinidad en el
cultivo del tomate y prácticas agronómicas de su manejo. Idesia (Arica), 25(3), 47-58.
http://dx.doi.org/10.4067/S0718-34292007000300006
Hajiboland, R.,
Aliasgharzadeh, A., Laiegh, S. F. & Poschenrieder, C. (2010). Colonization
with Arbuscular mycorrhizal fungi improve salinity tolerance of tomato (Solanum
lycopersicum L.) plants. Plant and Soil., 331(1), 313-327. https://doi.org/10.1007/s11104-009-0255-z
Horie, T., Karahara,
I. & Katsuhara, M. (2012). Salinity tolerance mechanisms in glycophytes:
an overview with the central focus on rice plants. Rice, 5(1),11-24.
doi:10.1186/1939-8433-5-11
Hotelling, H. (1951).
A generalized t test and measure of multivariate dispersion. Proceedings of the
Second Berkeley Symposium on Mathematical Statistics and Probability. Berkeley,
California: University of California Press
https://projecteuclid.org/download/pdf_1/euclid.bsmsp/1200500217
Kaveh, H., Nemati, H.,
Farsi, M. & Jartoodeh, S.V. (2011) How salinity affect germination and
emergence of tomato lines. Journal of Biological & Environmental
Sciences, 5(15), 159–163 http://jbes.uludag.edu.tr/.../mak07.pdf
Lamz Piedra, A. &
González Cepero, M. C. (2013). La salinidad como problema en la agricultura: la
mejora vegetal una solución inmediata. Cultivos Tropicales, 34(4),
31-42. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0258-59362013000400005&lng=es&tlng=es
Lara, F. S., Vallejo,
P. R., García, P. S., Villa, M. S., Muñoz, M. L., Rodríguez, J. C. C. &
Segovia, C. P. (2015). Tolerancia de líneas nativas de tomate (Solanum
lycopersicum L.) a la salinidad con NaCl. Interciencia, 40(10),
704-709.
https://www.redalyc.org/pdf/339/33941643009.pdf
Liedl, B. E., Labate,
J. A., Stommel, J. R., Slade, A. & Kole, C. (2013). Genetics,
Genomics, and Breeding of Tomato. Science Publishers Inc. USA. 520 p.
Magallanes-López, A.
M., Damián, T. M., Castellanos, J. S., Flores, L. J. P., Montes, I. M. M. &
Pérez, J. E. R. (2020). Calidad poscosecha de 40 poblaciones de tomate (Solanum
lycopersicum l.) nativas de México. Agrociencia, 54(6),
779-795. https://doi.org/10.47163/agrociencia.v54i6.2184
Maguire, J. D. (1962).
Speed of germination, aid in selection and evaluation of seedling emergence
vigor. Crop
Science, 2,176-177.
https://dl.sciencesocieties.org/publications/cs/abstracts/2/2/CS0020020176
Marín-Montes, I. M.,
Rodríguez-Pérez, J. E., Sahagún-Castellanos, J., Hernández-Ibáñez, L. &
Velasco-García, Á. M. (2016). Variación morfológica y molecular de 55 colectas
de tomate nativo de México. Revista Chapingo. Serie horticultura, 22(2),
117-132. https://doi.org/10.5154/r.rchsh.2016.03.008.
Morales, D.,
Dell'Amico, J., Rodríguez, P., Torrecillas, A. & Sánchez-Blanco, M. D. J.
(2010). Efecto del estrés por NaCl en el crecimiento y las relaciones hídricas
en plantas de tomate (Solanum lycopersicum L.) durante el periodo
vegetativo. Cultivos Tropicales, 31(4), 76-81. https://www.redalyc.org/articulo.oa?id=193218885010
Munns, R. (2005). Genes and
salt tolerance: bringing them together. New Phytologist, 167(3),
645– 63 https://doi.org/10.1111/j.1469-8137.2005.01487.x
Munns, R. &
Tester, M. (2008). Mechanisms of salinity tolerance. Annual review of plant
biology, 59, 651-681. https://doi.org/10.1146/annurev.arplant.59.032607.092911
Núñez-Colín, C. A.
& Escobedo-López, D. (2011). Uso correcto del análisis clúster en la
caracterización de germoplasma vegetal. Agronomía
mesoamericana, 22(2), 415-427. doi:10.15517/am.v22i2.8746
Parihar, P., Singh,
S., Singh, R., Singh, V. P. & Prasad, S. M. (2014). Effect of salinity
stress on plants and its tolerance strategies: a review. Environmental
Science and Pollution Research, 22(6), 4056-4075.
https://doi.org/10.1007/s11356-014-3739-1
Ruiz Espinoza, F. H.,
Villalpando Gutiérrez, R. L., Murillo Amador, B., Beltrán Morales, F. A. &
Hernández Montiel, L. G. (2014). Respuesta diferencial a la salinidad de
genotipos de tomate (Lycopersicon esculentum Mill.) en primeras etapas
fenológicas. Terra latinoamericana, 32(4), 311-323.
http://ref.scielo.org/yq4cm6
Singh, J., Sastry, D.
& Singh, V. (2012). Effect of salinity on tomato (Lycopersicon
esculentum Mill.) during seed germination stage. Physiology and
molecular biology of plants: an international journal of functional plant
biology. 18, 45-50. doi: 10.1007/s12298-011-0097-z
Statistical Analysis
System (SAS Institute). (1983). SAS technical report A108. Cubic clustering
criterion. Cary, N.C. USA, https://support.sas.com/documentation/onlinedoc/v82/techreport_a108.pdf
Tahir, M., Zafar, M.
M., Imran, A., Hafeez, M. A., Rasheed, M. S., Mustafa, H. S. B., Ullah, A.,
Saad, H. M. & Mustafa, B. (2018). Response of tomato genotypes against
salinity stress at germination and seedling stage. Nature and Science ,
16(4), 10-17. doi:10.7537/marsnsj160418.03.
Van Zelm, E., Zhang,
Y. & Testerink, C. (2020). Salt Tolerance Mechanisms of Plants. Annual
Review of Plant Biology, 71(1). doi:10.1146/annurev-arplant-050718-100005
Yurtseven, E., Kesmez
G. D. & Ünlükara, A. (2005). The effects of water salinity and potassium
levels on yield, fruit quality and water consumption of a native central
Anatolian tomato species (Lycopersicon esculentum). Agricultural Water Management, 78(1-2):
128–135 https://doi.org/10.1016/j.agwat.2005.04.018
Zhu, J. K. (2001)
Plant salt tolerance. Trends in Plant Science, 6(2),66–7.
https://doi.org/10.1016/S1360-1385(00)01838-0

![]() 10.57201/IEUNA2312777
10.57201/IEUNA2312777 ![]() ,Universidad
Nacional de Asunción.
,Universidad
Nacional de Asunción.![]() , Centro
de Desarrollo e Innovación Tecnológica (CEDIT)
, Centro
de Desarrollo e Innovación Tecnológica (CEDIT)![]()
![]() ,
José Oscar Mascorro Gallardo1
,
José Oscar Mascorro Gallardo1![]() , Juan
Enrique Rodríguez Pérez1
, Juan
Enrique Rodríguez Pérez1![]() ,
Jaime Sahagún Castellanos1
,
Jaime Sahagún Castellanos1![]() ,
José Luis Rodriguez de la O.1
,
José Luis Rodriguez de la O.1![]()