Ferreyra, D. J. & Martina, P. M. (2022). Aislamiento y
caracterización de levadura silvestre de frutas de Morus nigra para
producción de bebidas alcohólicas regionales. Revista investigaciones y estudios - UNA, 13(2), 49-58.
https://doi.org/10.47133/IEUNA22205b
Resumen. La fruta de la
morera es no solo conocida por su exquisito sabor, sino también por sus
cualidades nutricionales y elevado contenido de compuestos bioactivos. La
elaboración de vino de mora es uno de sus múltiples usos. Con el objetivo de
controlar el proceso de fermentación espontánea empleado en la elaboración de
vinos artesanales, se procedió al aislamiento de levaduras silvestre en el jugo
de mora. Se identificó por biología molecular Saccharomyces cerevisiae
como especie predominante. El aislado M01-IX se caracterizó por su tolerancia
al etanol y por cinética de consumo de carbohidratos. Los resultados muestran
que M01-IX es capaz de consumir el 99% del azúcar presente en las condiciones
ensayadas y podría ser empleado para producir bebidas fermentadas con un
contenido de al menos 5% de alcohol.
Palabras
clave. mora, fermentación, azúcar
residual, alcohol etílico, Saccharomyces cerevisiae.
Abstract. The mulberry fruit is not only known for its exquisite taste, but
also for its nutritional qualities and high content of bioactive compounds. The
elaboration of blackberry wine is one of its many uses. In order to control the
spontaneous fermentation process used in the production of artisanal wines,
wild yeasts were isolated in blackberry juice. Saccharomyces cerevisiae
was identified by molecular biology as the predominant species. The M01-IX
isolate was characterized by its tolerance to ethanol and by the kinetics of
carbohydrate consumption. The results show that M01-IX is capable of consuming
99% of the sugar present under the conditions tested and could be used to
produce fermented beverages with a content of at least 5% alcohol.
Keywords. blackberry, fermentation, residual sugar,
ethyl alcohol, Saccharomyces cerevisiae.
INTRODUCCIÓN
La morera negra (Morus nigra, Línneo 1753) pertenece a la
familia Moraceae. Esta fruta no climatérica se cosecha durante los meses
de septiembre y octubre en el hemisferio sur. El fruto de la morera es de 2 a 4
cm de largo, de forma ovalada con un color rojo brillante antes de la plena
madurez y es de color negro purpura cuando está completamente maduro (Darias-Martín
et al., 2003; Tao et al., 2017). La mora es conocida por su alto valor
nutricional y su rico contenido en compuestos bioactivos saludables como las
antocianinas, tiene una temporada de cosecha corta y es susceptible de
descomponerse durante el transporte y almacenamiento (Wang et al., 2013). El procesamiento
completo de esta fruta incluye la elaboración de varios productos, como
mermelada, jugo, jarabe, vinagre y bebidas alcohólicas (Tao et al., 2017).
Saccharomyces cerevisiae, utilizada en la industria de la panificación como agente leudante, es
la principal cepa de levadura responsable de la fermentación alcohólica. La
eficiencia de las cepas de levadura está determinada por su capacidad para
utilizar sustancias azucaradas, su tolerancia y capacidad de producción de
etanol (Karki et al., 2017). Sin embargo, otras características que a menudo se
desean para la fermentación de bebidas son los efectos potenciadores de la
calidad, como la generación de compuestos aromáticos deseables (Tao et al., 2017; Yezbick et al., 2013).
La producción de vino
a partir de frutas distintas de la uva ha aumentado en los últimos años.
Cualquier fruta que tenga una buena proporción de azúcar puede usarse para
hacer vino. Los vinos reciben principalmente el nombre de la fruta con la que
se han preparado (Varakumar et al., 2013). Hay diferentes tipos de bebidas
alcohólicas relacionadas con la mora, como el vino de mora (Juan et al., 2012),
el Yakju bebida alcohólica tradicional coreana enriquecida con morera (Kwak et al., 2012) y un
destilado producido por fermentación en estado sólido de morera negra en
Galicia (Alonso González et al., 2010).
En algunas
localidades de zonas turísticas de la provincia de Misiones existe una
tendencia creciente de emprendedores a elaborar vinos artesanales con frutas
regionales. Sin embargo, los mismos no cuentan prácticas de corrección en el
proceso de elaboración y conocimiento microbiológico que garantice un estándar
de calidad, dificultando en última instancia, la difusión del producto. En este
contexto, este trabajo se centró en la identificación y caracterización de la
levadura más representativa de las pulpas frescas de moras con capacidad
fermentadora para la producción de vino de mora.
MATERIALES Y MÉTODOS
Recolección de muestras
Los
frutos de tres ejemplares sanos del árbol de mora (“mora”, morera negra) se
recolectaron en Posadas, provincia de Misiones (27°24'12.6" S -
55°56'40.4" W), en bolsas de plástico de polietileno estéril y se
transportaron refrigeradas al laboratorio.
Fermentación del jugo de mora y
aislamiento de levaduras tolerantes
Las frutas fueron
lavadas dos veces en agua destilada y luego procesadas en una licuadora. El
jugo de mora con etanol (99,5%, Cicarelli, Argentina) al 3% (p/v), se mantuvo un
tanque de fermentación de 1 litro a 20°C, con una atmósfera estable y casi
completamente oscura durante 72 h. La fermentación se analizó para seleccionar
las levaduras tolerantes al etanol en la flora nativa presente (Wang et al.,
2013).
Una
alícuota (5 ml) de jugo fermentado se diluyó en serie (10-1-10-5)
y se sembraron (100 µl) en placa con medio Saboraud-agar (Britania S.A.,
Argentina) suplementado con antibiótico (cloranfenicol, 50 mg/L; Britania S.A.,
Argentina) y se incubó a 28°C ± 0,5% (San Jor SL30C, Argentina) durante 2-4
días (Peña y Arango, 2009). Las colonias de levaduras obtenidas se
subcultivaron hasta obtener colonias purificadas que se almacenaron en medio
mínimo Cary-Blair con glicerol a -20ºC.
Identificación
genética de levaduras tolerantes
La
identificación de las levaduras con tolerancia al etanol se realizó utilizando
la técnica de PCR y comparación de secuencias de ADNr descrita por White y col.
(White et al., 1990). La mezcla de reacción contenía cebadores específicos para
la región D1 / D2 de la gran subunidad ribosómica (28S rDNA), NL-1 (5-GCATATCAATAAGCGGAGGAAAAG-3)
y NL-4 (5-GGTCCGTGTTTCAAGACGG-3). La PCR se inició a 94°C durante 3 min y 30
ciclos de desnaturalización a 94°C durante 1 min, hibridación (annealing)
55°C durante 1 min, extensión a 72°C durante 5 min, con una extensión final a
72°C por 5 min. Los productos de amplificación se separaron por electroforesis
en un gel de agarosa al 1% (p/v) y se tiñeron con SYBR Green (Invitrogen, USA).
Luego, los productos se purificaron usando kit AccuPrep (Bioneer, Corea del
Sur). La secuenciación se realizó en Macrogen (Seúl, Corea del Sur) utilizando
el kit de reacción listo para secuenciación del ciclo terminador BigDye
(Applied Biosystems). Las secuencias se editaron manualmente y se alinearon
para generar una secuencia consenso usando la herramienta Clustal W (Thompson
et al., 1994). Las búsquedas de similitud se llevaron a
cabo usando el programa BLAST N del sitio web http://www.ncbi.nlm.nih.gov (Altschul
et al., 1990).
Tolerancia
al etanol
Se adoptó el criterio
de tolerancia como la concentración de etanol que reduce el crecimiento de las
levaduras en un 50% (I50) (Ramírez-Cota et al., 2021). Empleando el medio sintético en condiciones estáticas investigamos
la capacidad de tolerancia al etanol de la cepa M01-IX. Se
midió el crecimiento de las cepas de levadura a distintas concentraciones de
etanol, según You con modificación (You et al., 2003). Cada cultivo se inició
inoculando matraces Erlenmeyer de 50 ml que contenían 10 ml de medio líquido
YPD (Yeast Peptone Dextrose) (extracto de levadura 10 g/l, peptona 20
g/l, glucosa 20 g/l) suplementado con 5%, 7% y 10% (v/v) de etanol a una
densidad óptica (DO) a 660 nm (DO660) 0,02 (2,5x105
células por ml) con células de cultivos en fase media logarítmica en
crecimiento activo y se incubaron a 30°C durante 3 días (72 h). El crecimiento
fue monitoreado por DO cada 24 h. La cepa comercial Saccharomyces cerevisiae
(Calsa S.A., Argentina) se utilizó como referencia.
Los
valores medios y sus desviaciones estándar del crecimiento celular se
calcularon a partir de muestras por sextuplicado. Los resultados de los
experimentos fueron evaluados mediante análisis de varianza (ANOVA) y prueba de
Tukey post-hoc para determinar diferencias con significación estadística a un
nivel de confianza del 95%. El I50 se estimó mediante la regresión
logística no lineal de cuatro parámetros conocida como ecuación de Hill (Gadagkar & Call, 2015). Todos los análisis
fueron realizados con el paquete estadístico Statgraphics Centurion XVI.
Fermentación
discontinua estática
Las fermentaciones
discontinuas se realizaron a escala de laboratorio en matraces de agitación de
250 ml que contenían 100 ml de medio YPD, suplementado con sacarosa e
inoculados a DO 0,02 (2,5x105 células por ml). En medio sintético
luego de la esterilización en autoclave a 121ºC por 15 minutos se produce
aparición de fructosa por la hidrólisis de sacarosa (Chen, 2004).
El
contenido de carbohidratos en la mora se encuentra entre un 5-11%, lo que
resulta insuficiente para alcanzar contenido alcohólico aceptable por lo que se
adiciona sacarosa para alcanzar 16ºBrix (Darias-Martín et al., 2003; Juan et
al., 2012). El pH inicial fue de 6,5 para todos los ensayos. Los matraces se
incubaron a 30°C durante aproximadamente 120 h. Al comienzo de los experimentos
y cada 8 a 12 h, las muestras fueron recogidas para su análisis. La densidad
óptica y el consumo de azúcar se midieron en el caldo como se describe en
Métodos analíticos. Cada ensayo se realizó por duplicado.
Determinación de parámetros cinéticos
de crecimiento y rendimiento
Los
parámetros cinéticos velocidad específica de crecimiento, tiempo de latencia y
tiempo de generación se calcularon utilizando el modelo de Gompertz. Los
parámetros de ajuste del modelo de Gompertz fueron calculados por regresión no
lineal con el programa estadístico Statgraphics Centurion (versión 16.0)
utilizando el algoritmo Marquard (Rivas et al., 2014). El rendimiento de biomasa YX/S
(gramos de biomasa producidos por gramo de azúcar consumido) y el rendimiento
de etanol YE/S (gramos de etanol producidos por gramo de azúcar
consumido) se calcularon como la pendiente, ajustada por regresión lineal, de
los valores correspondientes de biomasa o etanol producido versus azúcar total
consumido en los intervalos de tiempo correspondientes (Rodrigues et al., 2015).
Métodos
analíticos
La DO se midió usando
un espectrofotómetro (Shimadzu UV-2550, Japón) a 660 nm. Los valores se
convirtieron en concentración de biomasa (g/l) mediante el uso de una curva
estándar. La biomasa se determinó mediante centrifugación (Zelían S.A.,
Argentina) de 1 ml de cultivo en tubos pesados previamente a 5.000 rpm durante
5 min. Se retiró el sobrenadante y el sedimento se secó en estufa y se pesó en
una balanza de precisión (APX-200, Denver Instrument, USA), hasta peso
constante (Peña y Arango, 2009).
Los
análisis de azúcares se realizaron por cromatografía líquida de alto
rendimiento (HPLC) utilizando muestras previamente centrifugadas a 13.000 g
durante 5 min. Los análisis se realizaron en un HPLC Shimadzu Prominence LC20
AT (Japón) equipado con un detector de índice de refracción ERC 7522 (ERMA INC,
Japón). Para analizar las concentraciones de azúcar se usó una columna Zorbax
amino NH2 4,6 x 250 mm, 5 um (Agilent, USA) con una fase móvil de
acetonitrilo/agua (85:15), elución isocrática con un flujo de 2 ml/min. a 35°C.
RESULTADOS
Selección
e identificación de levaduras
A
partir de los muestreos realizados, 10 cepas recuperadas
de la fermentación alcohólica del jugo de mora mostraron el carácter
morfológico de la levadura en placas con medio selectivo. El aislado M01-IX fue
seleccionado debido a su abundancia relativa, y los otros nueve aislados no
fueron estudiados. El análisis de la secuencia parcial (606 pb) del aislado
M01-IX (GenBank: MH844381.1) determinó un alto porcentaje (100%) de similitud
con Saccharomyces cerevisiae (MK908002.1).
Prueba
de tolerancia al etanol
El
crecimiento a diferentes concentraciones de etanol se presenta en la Tabla 1.
Los resultados muestran que la cepa silvestre M01-IX puede crecer a todas las
concentraciones ensayadas, sin embargo, el crecimiento se redujo significativamente
en función del incremento de alcohol. En la cepa de referencia las diferencias
en el crecimiento son significativas a partir de 7% de alcohol. En la Tabla 2,
se presentan los parámetros de la ecuación Hill, los cuales indican que las cepas
presentan diferentes tolerancias al etanol, siendo I50 5% y 8% para
las cepas M01-IX y referencia, respectivamente.
DISCUSIÓN
Las frutas son fuentes importantes de
levaduras debido a su gran cantidad de azúcares simples y a la frecuente visita
de vectores. La microbiota natural de las frutas está compuesta comúnmente de
levaduras y hongos levaduriformes de los géneros Aureobasidium, Rhodotorula, Sporobolomyces,
Cryptococcus, Brettanomyces, Candida, Pichia, Hanseniaspora y raramente Saccharomyces
y Schizosaccharomyces (Lee et al., 2011; Mambuscay et
al., 2013). En un
reporte previo se menciona que, en el jugo de mora la mitad de las especies (Pichia
kluyveri, Hansenia sporauvarum y Candida oleophila)
reportadas solo cuentan con un aislado, mientras que la especie Wickerhamomyces
pijperi está representada por 13 de las 28 cepas aisladas. Las especies Hanseniaspora
uvarum y Candida boidinii presentan 6 y 5 cepas respectivamente (Mambuscay
et al., 2013). Sin embargo, en nuestro estudio S. cerevisiae fue
la especie más abundante.
Tolerancia
al etanol
Nuestros resultados indican que la cepa
silvestre S. cerevisiae M01-IX tolera hasta un 5% de
etanol en el medio de cultivo. Estos resultados están de acuerdos a otros estudios,
en donde el rango de tolerancia al etanol en las levaduras fue entre 5 – 12% (Matapathi
et al., 2004; Tikka et al., 2013). En S.
cerevisiae, el aumento de la concentración de etanol como principal
producto de fermentación, influye en la fluidez de membrana, el metabolismo
celular y en la biosíntesis de macromoléculas, lo que lleva a la inhibición del
crecimiento e incluso a la muerte (Ding et al., 2009; You et al., 2003). Los resultados de análisis de genoma completo y de regulación de
transcripción, informan que los genes asociados con la función de la vacuola y
la biosíntesis de aminoácidos son importantes para la tolerancia al etanol. La
importancia del primero puede estar relacionada con la necesidad de funciones
basadas en vacuolas, como la homeostasis del pH intracelular, el mantenimiento
de la concentración de iones y la degradación de proteínas, en un momento en
que el estrés por etanol ha alterado los gradientes electroquímicos e iniciado
una considerable renovación de proteínas en la célula (Stanley et al., 2010;
Yang & Tavazoie, 2020).
Fermentación
discontinua estática
La capacidad fermentativa se ve influenciada por diferentes
factores, como la temperatura, la concentración de azúcares, el pH, y algunas
otras variables que influyen en el crecimiento de los microorganismos, es
decir, son responsables para una disminución en el rendimiento de biomasa
(Rodrigues et al., 2015; Wang et al., 2016). El rendimiento de biomasa en
M01-IX fue bajo. Esto es una ventaja en procesos en los que los productos y no
la biomasa son el objetivo industrial. Reportes para cepas silvestres de S. cerevisiae
indicaron valores de rendimiento de biomasa entre 0,022 – 0,644 g/g (González-Leos
et al., 2017). El rendimiento de etanol/azúcar obtenido para M01-IX (0,408 g/g)
se encuentra entre los mejores rendimientos reportados para producción de
etanol en condiciones similares para cepas silvestres que van de 0,048 – 0,505
g/g (González-Leos et al., 2017). No obstante, reportes indican una clara
reducción en la tasa de crecimiento de la levadura cuando el etanol está
presente en concentraciones entre 4 y 10 % (p/v) (Lee et al., 2011; Lima-Costa et al., 2012). En
este caso, la acumulación de etanol en el medio de cultivo al final de la fase
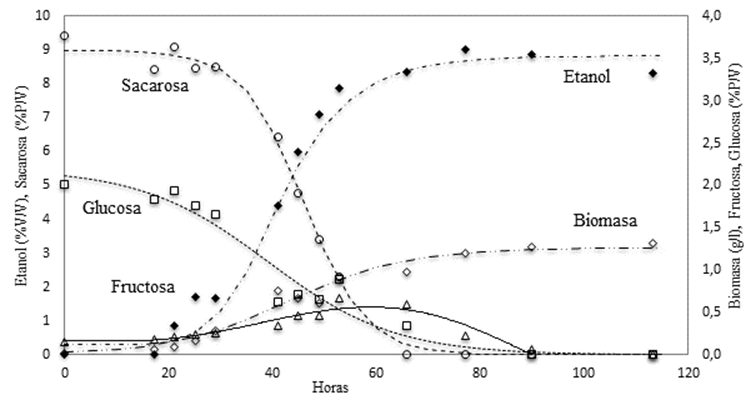
exponencial alcanzó concentraciones del 6,8% (v/v) (Figura 1). Esto sugirió que
el etanol presente en el caldo puede ser el factor etiológico de la inhibición
del consumo de azúcar y la consiguiente inhibición del crecimiento. Sin
embargo, también quedó claro que ambos procesos no se vieron afectados de la
misma manera, debido al desacoplamiento entre el crecimiento de biomasa y la
producción de etanol en la fase estacionaria, y la capacidad de las células de
no crecimiento para mantener una producción lenta de etanol.
Cinética del
consumo de azúcares
La
tasa de crecimiento puede ser afectada por cambios en la tasa específica de
consumo de azúcar (Lima-Costa et al., 2012). El jugo de mora natural posee
cantidades similares de glucosa y fructosa, pero no contiene sacarosa (Makhoul
et al., 2017). Para obtener mostos fermentables óptimos para la elaboración de
vinos debe suplementarse con la adición de azúcar (Darias-Martín et al., 2003).
Para conocer el comportamiento de la cepa M01-IX se midió el consumo de los
diferentes azúcares (glucosa, fructosa y sacarosa) presentes en el curso de la
fermentación (ver, Figura 1). Al inicio (t0) la concentración de
glucosa, fructosa y sacarosa en el medio de cultivo eran 20, 4 y 94 g/l.,
respectivamente. Durante la fase “lag” y la primera fase de crecimiento
exponencial (t22 h), solo se consumió glucosa. Durante la segunda
fase de crecimiento, la sacarosa se hidroliza, la glucosa es mantenida en
concentraciones bajas decreciente, mientras que la concentración de fructosa en
ese periodo se triplicó, lo que indica que los monosacáridos producidos por la
hidrólisis de la sacarosa se consumieron con diferente preferencia. La tercera
fase de crecimiento, fase estacionaria, continua la hidrólisis de sacarosa
hasta agotamiento, la glucosa se mantiene en valores bajos e inicia el consumo
de fructosa. Nuestras observaciones están en concordancia con reportes previos
(Lima-Costa et al., 2012; Rodrigues et al., 2015). En los cultivos de S.
cerevisiae la sacarosa es hidrolizada por la enzima invertasa, codificada
por el producto del gen Suc2.
En
presencia de glucosa en concentraciones mayores a 18mM la síntesis de invertasa
es reprimida (Meijer et al., 1998). Por ello, al inicio de la fermentación
cuando la glucosa está presente en alta concentración (más de 20 g/l en este
caso), la síntesis de invertasa se reprime y no se hidroliza sacarosa. La
hexosa permeasa solo trasporta monosacáridos al interior de la levadura, siendo
la glucosa mucho más afín. La concentración de glucosa se mantiene baja debido
a que es metabolizada a medida que está disponible, en simultáneo la
concentración de fructosa aumenta un poco, lo que implica que la tasa de
hidrólisis del azúcar es más alta que las tasas de transporte de monosacáridos.
En general, la menor afinidad de los
transportadores de hexosas por la fructosa en comparación con la glucosa
explica el predominio de la fructosa hacia el final de la fermentación
(Rodrigues et al, 2015).
CONCLUSIÓN
Las frutas maduras de la morera negra son
fuente de levaduras silvestres con capacidad fermentativa. El aislado M01-IX,
identificado como Saccharomyces cerevisiae presenta tolerancia al etanol
en las condiciones ensayadas y es capaz de metabolizar el 99% de azúcar
disponible durante fermentación, por lo cual presenta una característica
adecuada para la elaboración de bebidas de bajo contenido alcohólico y azúcar
residual.
AGRADECIMIENTO
Especialmente
agradecemos a Tatiana E. Ziegler por la asistencia técnica brinda en el
laboratorio. A Liliana S. Celaya por las sugerencias en la elaboración del
manuscrito final.
Fuente de Financiamiento. sin financiamiento externo.
REFERENCIAS
BIBLIOGRÁFICAS
Alonso
González, E., Torrado Agrasar, A., Pastrana Castro, L. M., Orriols Fernández,
I. & Pérez Guerra, N. (2010). Production and Characterization of Distilled Alcoholic Beverages
Obtained by Solid-State Fermentation of Black Mulberry (Morus nigra L.) and
Black Currant (Ribes nigrum L.). Journal of Agricultural and Food Chemistry, 58(4), 2529–2535.
doi:10.1021/jf9037562
Altschul, S. F.,
Gish, W., Miller, W., Myers, E. W. & Lipman, D. J. (1990). Basic local
alignment search tool. J. Mol. Biol., 215, 403–410.doi:10.1016/S0022-2836(05)80360-2
Chen, J. (2004).
Manual de azúcar de caña (2 ed.). Limusa SA.
Darias-Martín, J.,
Lobo-Rodrigo, G., Hernández-Cordero, J., Díaz-Díaz, E. & Díaz-Romero, C.
(2003). Alcoholic beverages
obtained from black mulberry. Food Technology and Biotechnology, 41(2),
173–176.
Ding, J., Huang,
X., Zhang, L., Zhao, N., Yang, D. & Zhang, K. (2009). Tolerance and stress
response to ethanol in the yeast Saccharomyces cerevisiae. Applied
Microbiology and Biotechnology, 85(2), 253–263. doi: 10.1007/s00253-009-2223-1
Gadagkar, S. R.
& Call, G. B. (2015). Computational tools for fitting the Hill equation to
dose–response curves. Journal of
Pharmacological and Toxicological Methods, 71, 68–76. doi: 1016/j.vascn.2014.08.006
González-Leos, A., Del
Angel-Del Angel, J. A., González-Castillo, J. L., Rodríguez-Durán, N. &
Bustos-Vázquez, G. (2017). Evaluación de levaduras nativas productoras de
etanol presentes en el bagazo de caña de azúcar. CienciaUAT, 11(2), 80.
doi:10.29059/cienciauat.v11i2.791
Juan, C., Jianquan,
K., Junni, T., Zijian, C. & Ji, L. (2012). The profile in polyphenols and volatile compounds in alcoholic
beverages from different cultivars of mulberry. Journal of Food Science, 77(4),
C430–C436. doi:10.1111/j.1750-3841.2011.02593.x
Karki, T. B.,
Timilsina, P. M., Yadav, A., Pandey, G. R., Joshi, Y., Bhujel, S., Adhikari,
R.& Neupane, K. (2017). Selection and characterization of potential baker’s
yeast from indigenous resources of Nepal. Biotechnology Research International, 2017, 1–10. doi:10.1155/2017/1925820
Kwak, E.J., Yeon
Lee, J. & Sook Choi, I. L. (2012). Physicochemical properties and
antioxidant activities of korean traditional alcoholic beverage, Yakju,
enriched with mulberry. Journal of Food Science, 77(7), C752–C758.doi:10.1111/j.1750-3841.2012.02753.x
Lee, Y. J., Choi,
Y. R., Lee, S. Y., Park, J. T., Shim, J. H., Park, K. H.& Kim, J. W.
(2011). Screening wild yeast strains for alcohol fermentation from various
fruits. Mycobiology,39(1), 33–39.doi:10.4489/MYCO.2011.39.1.033
Lima-Costa, M. E.,
Tavares, C., Raposo, S., Rodrigues, B. & Peinado, J. M. (2012). Kinetics of sugars consumption and ethanol
inhibition in carob pulp fermentation by Saccharomyces cerevisiae in batch and
fedbatch cultures. Journal of Industrial Microbiology and Biotechnology, 39(5), 789–797.doi:10.1007/s10295-011-1079-4
Makhoul, G.,
Mahfoud, H. & Baroudi, H. (2017). Some chemical characteristics of white
(Morus alba L) and black (Morus nigra L) mulberry phenotypes in Tartus Syria. International
Journal of Agriculture & Environmental Science, 4(2), 54–63.
doi:10.14445/23942568/ijaes-v4i2p110
Mambuscay M., L.
A., A. López A., W., M. Cuervo M., R. A., Argote V., F. E. & Osorio C., E.
(2013). Identification of yeast in the native pineapple juice, blackberry and
grape. Biotecnología en el
Sector Agropecuario y Agroindustrial, 11(Num. Esp. 2), 136–144.
Matapathi, S. S.,
Patil, A. B., Jones Nirmalnath, P. & Savalagi, V. V. (2004). Isolation and screening of efficient yeast
strains for wine making. Karnataka Journal of Agricultural Sciences, 17(4),
736–740.
Meijer, M. M. C.,
Boonstra, J., Verkleij, A. J. &Verrips, C. T. (1998). Glucose repression in
Saccharomyces cerevisiae is related to the glucose concentration rather than
the glucose flux. Journal of Biological
Chemistry, 273(37), 24102–24107.
doi:10.1074/jbc.273.37.24102
Peña, C. &
Arango, R. (2009). Evaluación de la producción de etanol utilizando cepas
recombinantes de Saccharomyces cerevisiae a partir de melaza de caña de azúcar.
Dynarev.fac.nac.minas, 76(159), 153–161.
Ramírez-Cota, G. Y.,
López-Villegas, E. O., Jiménez-Aparicio, A. R. & Hernández-Sánchez, H.
(2021). Modeling the ethanol
tolerance of the probiotic yeast Saccharomyces cerevisiae var. boulardii CNCM
I-745 for its possible use in a functional beer. Probiotics and Antimicrobial. Proteins, 13(1),
187–194. doi:10.1007/s12602-020-09680-5
Rivas, E.-M., Gil de
Prado, E., Wrent, P., Silóniz, M.-I., Barreiro Elorza, P., Correa Hernando, E.
C., Conejero, F., Murciano, A. & Peinado, J. M. (2014). A simple mathematical model that describes
the growth of the area and the number of total and viable cells in yeast
colonies. Letters in Applied Microbiology, 59(6), 594–603. doi:10.1111/lam.12314
Rodrigues, B.,
Peinado, J. M., Raposo, S., Constantino, A., Quintas, C., & Lima-Costa, M.
E. (2015). Kinetic and
energetic parameters of carob wastes fermentation by Saccharomyces cerevisiae:
Crabtree effect, ethanol toxicity, and invertase repression. Journal of Microbiology and Biotechnology, 25(6), 837–844. doi:10.4014/jmb.1408.08015
Stanley, D.,
Bandara, A., Fraser, S., Chambers, P. J. & Stanley, G. A. (2010). The
ethanol stress response and ethanol tolerance of Saccharomyces cerevisiae. Journal
of Applied Microbiology, 109(1), 13–24. doi:10.1111/j.1365-2672.2009.04657.x
Tao, Y., Wang, Y.,
Yang, J., Wang, Q., Jiang, N., Chu, D. T., Han, Y. & Zhou, J. (2017).
Chemical composition and sensory profiles of mulberry wines as fermented with
different Saccharomyces cerevisiae strains. International Journal of Food
Properties, 20(00), 2006–2021. doi:10.1080/10942912.2017.1361970
Thompson, J. D.,
Higgins, D. G. & Gibson, T. J. (1994). CLUSTAL W: improving the sensitivity
of progressive multiple sequence alignment through sequence weighting,
position-specific gap penalties and weight matrix choice. Nucleic Acids
Research, 22(22), 4673–4680. doi:10.1093/nar/22.22.4673
Tikka, C., Osuru,
H. P., Atluri, N., Raghavulu, P. C. V., Yellapu, N. K., Mannur, I. S., Prasad,
U. V., Aluru, S., Varma K. N. & Bhaskar, M. (2013). Isolation and
characterization of ethanol tolerant yeast strains. Bioinformation, 9(8),
421–425. doi:10.6026/9732063 0009421
Varakumar, S.,
Naresh, K., Variyar, P. S., Sharma, A., & Reddy, O. V. S. (2013). Role of
malolactic fermentation on the quality of mango (Mangifera indica L.) Wine. Food
Biotechnology, 27(2), 119–136. doi:10.1080/08905436.2013.781506
Wang, C., Yin, L.-Y.
Y., Shi, X.-Y., Xiao, H., Kang, K., Liu, X. Y., Zhan, J. C., & Huang, W.-D.
(2016). Effect of cultivar, temperature, and environmental conditions on the
dynamic change of melatonin in mulberry fruit development and wine
fermentation. Journal of Food Science, 81(4), M958–M967.doi:10.1111/1750-3841.13263
Wang, C-Y, Liu, Y.-W.,
Jia, J.-Q., Sivakumar, T. R., Fan, T., & Gui, Z.-Z. (2013). Optimization of
fermentation process for preparation of mulberry fruit wine by response surface
methodology. African Journal of
Microbiology Research, 7(3),
227–236. doi:10.5897/AJMR12.2090
White, T., Bruns,
T., Lee, S. & Taylor, J. (1990). Amplification and direct sequencing of
fungal ribosomal RNA genes for phylogenetics (PCR-Prot). Academic Press.In M.A
Innis., D. H Gelfand,. J.J. Shinsky and White, T.J., Eds., PCR. Protocols: A
Guide to Methods and Applications, Academic Press, Inc., New York. doi: 10.1016/b978-0-12-372180-8.50042-1
Yang, J.
&Tavazoie, S. (2020). Regulatory and evolutionary adaptation of yeast to
acute lethal ethanol stress. PLOS ONE, 15(11), e0239528.doi:10.1371/journal.pone.0239528
Yezbick, G.,
Ahn-Jarvis, J., Schwartz, S. J.&Vodovotz, Y. (2013). Physicochemical
characterization and sensory analysis of yeast-leavened and sourdough soy
breads. Journal of Food Science, 78(10), 1–17. doi:10.1111/1750-3841.12246.
You, K. M.,
Rosenfield, C.-L. &Knipple, D. C. (2003). Ethanol tolerance in the yeast
Saccharomyces cerevisiae is dependent on cellular oleic acid content. Applied and Environmental Microbiology, 69(3), 1499–1503. doi:10.1128/AEM.69.3.1499-1503.2003
![]() , Pablo Francisco Martina1,2*
, Pablo Francisco Martina1,2*![]() 1Universidad Nacional de Misiones. Facultad de Ciencias
Exactas, Químicas y Naturales. Posadas, Argentina. 2Consejo Nacional
de Investigaciones Científicas y Técnicas. Instituto de Biología Subtropical. Posadas,
Argentina. *Autor de correspondencia: pfmartina@hotmail.com.
1Universidad Nacional de Misiones. Facultad de Ciencias
Exactas, Químicas y Naturales. Posadas, Argentina. 2Consejo Nacional
de Investigaciones Científicas y Técnicas. Instituto de Biología Subtropical. Posadas,
Argentina. *Autor de correspondencia: pfmartina@hotmail.com.